
| ||
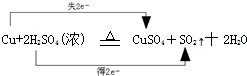 ,
,
| ||
 ;
;

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
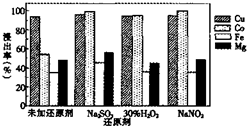
| A、是否使用还原剂对铜的浸出率影响很大 |
| B、用Na2SO3NaNO2作还原剂,钴的浸出率 均达98%,但工业上宜选用Na2SO3 |
| C、加入还原剂的主要目的是为了还原Fe3+ |
| D、用Na2SO3作还原剂可使镁元素以单质 形式析出而有较大浸出率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
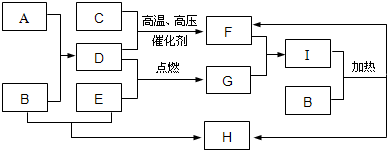
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | Cl-Cl | H-H | H-Cl | N≡N |
| 键能:kJ/mol | 243 | 436 | 431 | 946 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
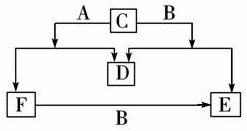
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验目的 | 实验操作 | |
| A | 证明乙烯能发生加成反应 | 将乙烯气体通入溴的四氯化碳溶液中 |
| B | 鉴别Fe(OH)3胶体和FeCl3溶液 | 用激光笔分别照射两种物质,从侧面观察是否出现光亮的通路. |
| C | 检验酒精中是否含有水 | 取少量酒精加入无水硫酸铜粉末 |
| D | 鉴别苯、环已烯和已烷 | 加入酸性高锰酸钾溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO42-、HCO3-、Na+、H+ |
| B、K+、SO42-、Fe3+、NO3- |
| C、H+、Na+、Cl-、CO32- |
| D、Ca2+、OH-、CO32-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、液氨的电离度 |
| B、液氨的离子积常数 |
| C、c(NH4+) |
| D、c(NH2-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com