
 �����£���1L1mol•L-1Na2SO3��Һ����SO2ʱ����ҺpH��SO2�����ʵ����ı仯��ͼ��ʾ������˵����ȷ���ǣ�������
�����£���1L1mol•L-1Na2SO3��Һ����SO2ʱ����ҺpH��SO2�����ʵ����ı仯��ͼ��ʾ������˵����ȷ���ǣ�������| A�� | Na2SO3��Һ�У�c��Na+����c��SO32-����c��HSO3-����c��OH-����c��H+�� | |
| B�� | ������Һ������ʱ��c��Na+��=c��HSO3-��+2c��SO32-�� | |
| C�� | M ��ʱ��Һ�У�c��SO32-����c��HSO3-�� | |
| D�� | ��N�������Һ�м�ˮ��ʹ��Һ��pH��6.2���ߵ�7.4 |
���� A��Na2SO3��Һ������������ӷֲ�ˮ����Һ�Լ��ԣ�
B����Һ�д��ڵ���غ㣬c��Na+��+c��H+��=2c��SO32-��+c��OH-��+c��HSO3-����������Һ������ʱc��H+��=c��OH-����
C��M��PH=7.4��n��SO2��=$\frac{1}{3}$mol��Na2SO3+SO2+H2O=2NaHSO3����Һ�õ�$\frac{2}{3}$molNaHSO3��$\frac{2}{3}$molNa2SO3����Һ�Լ��ԣ������������ˮ���Լ��ԣ�������������ӵ��������ԣ�
D��N��PH=6.2����Һ�����ԣ�n��SO2��=$\frac{5}{6}$mol��Na2SO3+SO2+H2O=2NaHSO3����Һ�õ�$\frac{10}{6}$molNaHSO3��$\frac{1}{6}$molNa2SO3����Һ�����ԣ�˵��������������ӵ�����������������ˮ�⣻
��� �⣺A��Na2SO3��Һ�У�c��Na+����c��SO32-����c��OH-����c��HSO3-����c��H+������A����
B����Һ�д��ڵ���غ㣬c��Na+��+c��H+��=2c��SO32-��+c��OH-��+c��HSO3-����������Һ������ʱc��H+��=c��OH-����c��Na+��=c��HSO3-��+2c��SO32-������B��ȷ��
C��M��PH=7.4��n��SO2��=$\frac{1}{3}$mol��Na2SO3+SO2+H2O=2NaHSO3����Һ��õ�$\frac{2}{3}$molNaHSO3��$\frac{2}{3}$molNa2SO3�������������ˮ���Լ��ԣ�������������ӵ��������ԣ���Һ�Լ��ԣ������������ˮ��̶ȴ���c��SO32-����c��HSO3-������C����
D��N��PH=6.2����Һ�����ԣ�n��SO2��=$\frac{5}{6}$mol��Na2SO3+SO2+H2O=2NaHSO3����Һ�õ�$\frac{10}{6}$molNaHSO3��$\frac{1}{6}$molNa2SO3����Һ�����ԣ�˵��������������ӵ�����������������ˮ�⣬��ˮ��ʹ��Һ��pH��6.2�ӽ�7�����������Լ��ԣ���D����
��ѡB��
���� ���⿼����ͼ������жϡ�����Һ��ˮ��͵���ıȽϡ�����Ũ�ȱȽϣ����ջ����ǽ���ؼ�����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 28% | B�� | 56% | C�� | 72% | D�� | 80% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 6�� | B�� | 7�� | C�� | 8�� | D�� | 9�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | HCl��NaOH��Ӧ���к��ȡ�H=-57.3kJ/mol����H2SO4��Ca��OH��2��Ӧ���к��ȡ�H=2����-57.3��kJ/mol | |
| B�� | CO��g����ȼ������283.0kJ/mol����2CO2��g��=2CO��g��+O2��g����Ӧ�ġ�H=+566.0kJ/mol | |
| C�� | �����������Ҫ���Ȳ��ܷ����ķ�Ӧ����˷�Ӧ�����ȷ�Ӧ | |
| D�� | 1mol����ȼ������ˮ�Ͷ�����̼���ų����������Ǽ���ȼ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
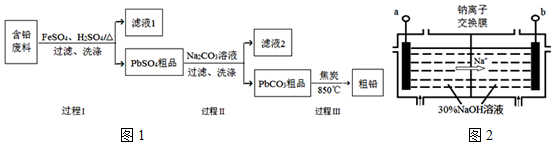
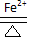 2PbSO4+2H2O��
2PbSO4+2H2O���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 �����£���0.100mol/L NaOH ��Һ�ֱ�ζ�20.00mL 0.100mol/L������ʹ��ᣬ�ζ�������ͼ��ʾ������˵����ȷ���ǣ�������
�����£���0.100mol/L NaOH ��Һ�ֱ�ζ�20.00mL 0.100mol/L������ʹ��ᣬ�ζ�������ͼ��ʾ������˵����ȷ���ǣ�������| A�� | ��ֱ��ʾ����ʹ���ĵζ����� | |
| B�� | pH=7ʱ������������NaOH��Һ�������� | |
| C�� | V��NaOH��=10.00 mL ʱ$\frac{c��C{H}_{3}CO{O}^{-}��}{c��C{H}_{3}COO��}$��1 | |
| D�� | V��NaOH��=20.00 mL ʱ��c��Cl-����c��CH3COO-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ɼ�������KMnO4��Һ���𱽡��Ҵ������Ȼ�̼ | |
| B�� | ̼������Һ����������Һ�����ж����ЧӦ | |
| C�� | ú�ĸ���ʯ�͵ķ�����֬��ˮ�ⶼ�ǻ�ѧ�仯 | |
| D�� | ������ϡ������Һ���Ⱥ����������Һ����ˮԡ���Ȳ���������֤������ˮ��������������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com