
| A. | 用标准FeCl3溶液滴定KI溶液,选择KSCN溶液 | |
| B. | 用I2溶液滴定Na2SO3溶液,淀粉作指示剂 | |
| C. | 用AgNO3溶液滴定NaCl溶液,Na2CrO4作指示剂 | |
| D. | 用H2O2溶液滴定KI溶液,淀粉作指示剂 |
分析 A.KSCN溶液遇铁离子显血红色;
B.淀粉遇碘显蓝色;
C.AgCl溶解度比Ag2CrO4溶解度小,氯离子沉淀完全后生成砖红色沉淀Ag2CrO4;
D.双氧水讲将碘离子氧化为碘单质,淀粉遇碘显蓝色.
解答 解:A、铁离子与碘离子反应,生成亚铁离子和碘单质,KSCN溶液遇铁离子显血红色,当溶液显血红色时,说明碘离子反应完全,达到滴定终点,故A正确;
B、淀粉遇碘单质显蓝色,当溶液显蓝色时,说明亚硫酸根离子已经被碘单质充分氧化,碘单质剩余,达到滴定终点,故B正确;
C、Ag2CrO4是砖红色沉淀,当溶液中有砖红色沉淀时,待测液中的氯离子被充分沉淀,银离子剩余,故C正确;
D、待测液中的碘离子被双氧水氧化生成碘单质,淀粉显蓝色,即一滴定就出现蓝色,蓝色加深,碘离子反应完全时,蓝色不再加深,但是不易观察,不能判断滴定终点,故D错误.
故选D.
点评 本题考查了滴定反应中的终点判定,考生应掌握常见的指示剂.


科目:高中化学 来源: 题型:多选题
| A. | 等体积、等物质的量浓度的氨水与盐酸混合 | |
| B. | 常温下,pH=8的氨水与pH=6的硝酸等体积混合 | |
| C. | 常温下,pH=12的Ba(OH)2溶液与pH=2的NaHSO4溶液等体积混合 | |
| D. | c(H+)=c(OH-)=10-6 mol•L-1的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
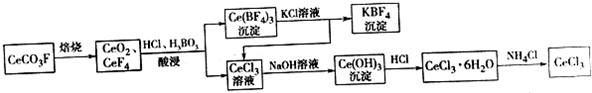
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 1-溴丙烷常用作有机反应的溶剂.实验室制备1-溴丙烷(CH3CH2CH2Br)的反应和主要实验装置如下:
1-溴丙烷常用作有机反应的溶剂.实验室制备1-溴丙烷(CH3CH2CH2Br)的反应和主要实验装置如下:| 相对分 子质量 | 密度 /g•mL-1 | 沸点/℃ | 水中 溶解性 | |
| 正丙醇 | 60 | 0.896 | 97.1 | 溶 |
| 正丙醚 | 102 | 0.74 | 90 | 几乎不溶 |
| 1-溴丙烷 | 123 | 1.36 | 71 | 不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知酸性高锰酸钾溶液是常用的强氧化剂,可以和草酸钠、二氧化硫等还原性物质发生氧化还原反应.
已知酸性高锰酸钾溶液是常用的强氧化剂,可以和草酸钠、二氧化硫等还原性物质发生氧化还原反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.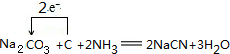 .
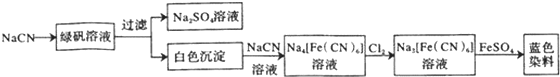
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
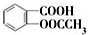 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐为主要原料合成阿司匹林,反应原理如下:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐为主要原料合成阿司匹林,反应原理如下: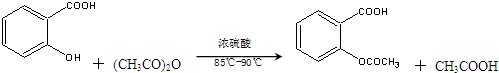
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水溶性 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 易水解 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
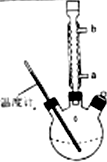
查看答案和解析>>
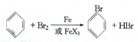
科目:高中化学 来源: 题型:实验题
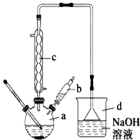 溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:
溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:| 苯 | 溴 | 溴苯 | |
| 密度/gcm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 在水中的溶解度 | 微溶 | 微溶 | 微溶 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间 | c(CO)/mol•L-1 | c(H2)/mol•L-1 | c(CH3OH)/mol•L-1 |
| 起始 | 1 | 3 | 0 |
| 第2min | 0.8 | 2.6 | 0.2 |
| 第4min | 0.4 | 1.8 | 0.6 |
| 第6min | 0.4 | 1.8 | 0.6 |
| A. | 第4 min至第6 min该化学反应处于平衡状态 | |
| B. | 第2 min时,如果只改变某一条件,则改变的条件可能加入了H2 | |
| C. | 第2 min时,如果只改变某一条件,则改变的条件可能是使用催化剂 | |
| D. | 第6 min时,其他条件不变,如果升高温度,正反应速率增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com