
【题目】某城市为了减少钢管因锈蚀造成的损失,拟用如图方法保护埋在酸性土壤中的钢管。下列有关说法正确的是( )
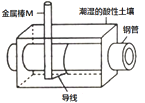
A. 在潮湿的酸性土壤中钢管主要发生化学腐蚀
B. 在潮湿的酸性土壤中金属棒M将电子通过导线流向钢管
C. 在潮湿的酸性土壤中H+向金属棒M 移动,抑制H+与铁的反应
D. 钢管与金属棒M也可用导线分别连接直流电源正、负极以使钢管表面的腐蚀电流接近于零
 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】太阳能电池的发展已经进入了第三代。第三代就是铜铟镓硒CIGS等化合物薄膜太阳能电池以及薄膜硅系太阳能电池。完成下列填空:
(1)亚铜离子(Cu+)基态时的电子排布式为_______________________。
(2)比较硒和同周期相邻的元素砷的第一电离能I1的大小:I1(As)__I1(Se)。用原子结构观点加以解释______________________________________________。
(3)与镓元素处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成加合物,如BF3能与NH3 反应生成BF3·NH3,BF3·NH3中N 原子的杂化轨道类型为__________________,B与N 之间形成________键。
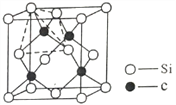
(4)单晶硅的结构与金刚石结构相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子不成键,则得如图所示的金刚砂(SiC) 结构。金刚砂晶体属于_________(填晶体类型),在SiC结构中,每个C原子周围最近的C原子数目为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组比较中,正确是
A.原子半径:Al>Mg>NaB.稳定性:HF>H2O>NH3
C.酸性:H2CO3>H2SO4>HClO4D.碱性:Al(OH)3>Mg(OH)2>NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式不正确的是( )
A.CH3CO18OC2H5+H2O ![]() CH3COOH和C2H518OH
CH3COOH和C2H518OH
B.溴乙烷与氢氧化溶液共热:CH3CH2Br+NaOH ![]() CH3CH2OH+NaBr
CH3CH2OH+NaBr
C.蔗糖水解: ![]() +H2O
+H2O ![]()
![]()
D.苯酚钠中通入二氧化碳: ![]() +CO2+H2O→
+CO2+H2O→ ![]() +NaHCO3
+NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应自发性的说法正确的是( )
A. 放热反应一定是自发进行的反应
B. 反应的自发性要综合考虑焓变和熵变两种因素
C. 化学反应的熵变与反应的方向无关
D. 只有不需要任何条件就能够自动进行的过程才是自发过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取,纯净的A为无色粘稠液体,易溶于水.为研究A的组成与结构,进行实验如表所示:
实验步骤 | 解释或实验结论 |
称取A9.0g,升温使其变化,测其密度是相同条件下H2的45倍 | ①A的相对分子质量为 |
将此9.0gA在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g | ②A的分子式为 |
另取A9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况) | ③用结构简式表示A中含有的官能团 |
A的核磁共振氢谱如图: | ④综上所述,A的结构简式为 |
⑤已知两分子A在一定条件下可生成六元环状酯,写出该反应的化学方程式: . | |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一. 
①钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的正极反应式为 .
②为了降低某水库的铁闸门被腐蚀的速率,可以采用如图甲所示的方案,其中焊接在铁闸门上的固体材料 R 可以采用 .
A.铜B.锡C.锌D.石墨
③如图乙方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的极上.
(2)根据反应 Fe+Fe2(SO4)3═3FeSO4设计的双液原电池如图丙所示.
①电极Ⅰ的材料为金属铁,则烧杯 A 中的电解质溶液为(填化学式)
②电极Ⅱ发生的电极反应式为 .
(3)某同学组装了如图丁所示的电化学装置.电极Ⅰ为 Al,其他电极均为 Cu. ①电极Ⅰ为极(填“正”“负”或“阴”“阳”),发生反应(填“氧化”或“还 原”),电极反应式为;电极Ⅲ为极(填“正”“负”或“阴”“阳”).
②盐桥中盛有含 KNO3 溶液的琼脂,盐桥中的 K+向极(填“Ⅰ”或“Ⅱ”)移动.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1032molL﹣1 HCl溶液滴定未知浓度的NaOH溶液,
(1)某同学按下列步骤进行实验:①取一锥形瓶,用待测NaOH溶液润洗两次; ②在锥形瓶中加入 25,.00 mL待测NaOH溶液;③加入几滴石蕊试剂做指示剂;④取一支酸式滴定管,洗涤干净; ⑤直接往酸式滴定管中注入标准酸溶液,进行滴定; ⑥两眼注视着滴定管内盐酸溶液液面下降,直至滴定终点.
其中所述操作有错误的序号为
(2)取用25.00 mL待测NaOH溶液应用以下(选填:“甲”、“乙”)装置,若取用NaOH溶液开始平视读数、结束时俯视读数,会导致所测氢氧化钠溶液浓度(填“偏大““偏小“或“不变“) ![]()
(3)若滴定开始前滴定管尖嘴中有一气泡,滴定结束后气泡消失, 则会导致所测氢氧化钠溶液浓度(填“偏大““偏小“或“不变“)
(4)若平行实验三次,记录的数据如下表
滴定次数 | 待测溶液的体积(/mL) | 标准HCl溶液的体积 | |
滴定前读数(/mL) | 滴定后读数(/mL) | ||
① | 25.00 | 1.02 | 21.04 |
② | 25.00 | 2.00 | 22.98 |
③ | 25.00 | 0.20 | 20.18 |
试计算待测NaOH溶液的物质的量浓度(列出计算过程).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com