
| A.同周期元素中,ⅦA族元素的原子半径最大 |
| B.ⅥA族元素的原子,其半径越大,越容易得到电子 |
| C.在元素周期表中最容易找到半导体材料的合理位置是过渡元素区 |
| D.元素周期表中从ⅢB到ⅡB这10个纵行的元素都是金属元素. |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子序数为7 | B.周期表中第一电离能最小 |
| C.周期表中原子半径最大 | D.周期表中电负性最大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.ⅠA族元素成键时不可能有杂化轨道 |
| B.s轨道和p轨道不可能有sp4出现 |
| C.杂化轨道既可能形成σ键,也可能形成π键 |
| D.孤对电子有可能参加杂化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氢化物沸点:HI>HBr>HCl>HF | B.离子半径:K+>Cl->S2- |
| C.分子稳定性:HF>HCl>HBr>HI | D.单质熔点:Li<Na<K<Rb |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.零族元素的单质在常温下都是气体 |
| B.第ⅡA族元素都是金属元素 |
| C.Fe位于周期表的第四周期,第ⅧB族 |
| D.第ⅦA族元素的单质在常温下有气态、液态、固态 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 电离能/kJ·mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
| | NaNO3 | KNO3 | NaCl | KCl |
| 10℃ | 80.5 | 20.9 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
 案:
案:
 100℃的饱和溶液,冷却至室温后抽滤。得KNO3纯品。
100℃的饱和溶液,冷却至室温后抽滤。得KNO3纯品。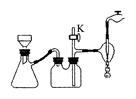
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径:甲<乙 甲 乙 丙 丁 戊 |
| B.非金属性:乙<丁 |
| C.最高价氧化物的水化物的酸性:丙<丁 |
| D.最外层电子数:丙>丁>戊 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com