
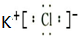 ,B元素基态原子的电子排布图为
,B元素基态原子的电子排布图为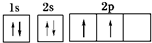 .
.分析 A、B、C、D四种元素,C2-离子与氩原子具有相同的电子层结构,则C为S元素;B有两个电子层,其最高正化合价与最低负化合价的代数和为零,最外层电子数为4,故B为C元素;A的最高正价与其最低负价的代数和为6,则A处于ⅦA族,A次外层电子数是8个,则A为Cl元素;D次外层电子数是8个,A和D的化合物DA在水溶液中能电离出具有相同电子层结构的阴、阳离子,A为Cl元素,A离子带1个单位负电荷,核外电子数为18,所以D的阳离子带1个单位正电荷,核外电子数为18,故D为K元素,据此进行解答.
解答 解:A、B、C、D四种元素,C2-离子与氩原子具有相同的电子层结构,则C为S元素;B有两个电子层,其最高正化合价与最低负化合价的代数和为零,最外层电子数为4,故B为C元素;A的最高正价与其最低负价的代数和为6,则A处于ⅦA族,A次外层电子数是8个,则A为Cl元素;D次外层电子数是8个,A和D的化合物DA在水溶液中能电离出具有相同电子层结构的阴、阳离子,A为Cl元素,A离子带1个单位负电荷,核外电子数为18,所以D的阳离子带1个单位正电荷,核外电子数为18,故D为K元素,
(1)根据分析可知,A为Cl元素,B为C元素、C为S元素、D为K元素,
故答案为:C;S;
(2)A为氯元素,D为钾元素,DA为KCl,由钾离子与氯离子构成,其电子式为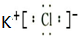 ;
;
B为C元素,C元素的原子序数为6,碳原子核外电子总数为6,则碳元素基态原子的电子排布图为: ,
,
故答案为: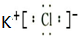 ;
; ;
;
(3)BA4为CCl4,CCl4中含有4个C-Cl共价键,属于σ键;从共价键极性来看属于 极性键,由于四氯化碳分子中具有对称结构,则CCl4分子属于非极性分子,
故答案为:σ;极性;非极性.
点评 本题考查了位置、结构与性质关系及其综合应用用,题目难度中等,推断元素为解答关键,注意掌握元素周期律内容、元素周期表结构,(3)为易错点,注意掌握判断共价键极性及分子极性的判断方法.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16 | B. | 32 | C. | 48 | D. | 64 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2++2OH-═Cu(OH)2↓ CuCO3+2NaOH═Cu(OH)2↓+Na2CO3 | |
| B. | CO32-+2H+═CO2↑+H2O BaCO3+2HCl═BaCl2+CO2↑+H2O | |
| C. | Ca2++CO32-═CaCO3↓ Ca(NO3)2+NaHCO3═CaCO3↓+Na(NO3)2 | |
| D. | H++OH-═H2O 2KOH+H2SO4═K2SO4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
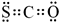 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
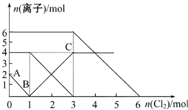 向FeI2、FeBr2的混合溶液中通入适量的氯气,溶液中某些离子的物质的量变化如图所示.下列有关说法中正确的是( )
向FeI2、FeBr2的混合溶液中通入适量的氯气,溶液中某些离子的物质的量变化如图所示.下列有关说法中正确的是( )| A. | 离子的还原性顺序为:Fe2+>Br->I- | |
| B. | 原混合溶液中FeBr2的物质的量为4mol | |
| C. | 原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3 | |
| D. | 当通入2 mol Cl2时,溶液中发生的离子反应可表示为:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维的主要成分是高纯度的单质硅 | |
| B. | 硅在地壳中的含量仅次于氧,自然界中存在大量单质硅 | |
| C. | 硅的化学性质不活泼,常温下不与任何物质起反应 | |
| D. | 硅同素异形体有晶体硅和无定形硅,晶体硅是灰黑色有金属光泽的固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com