
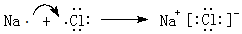 .
.分析 A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A的最外层电子数是次外层电子数2倍,A原子只能有2个电子层,最外层电子数为4,则A为碳元素;B是短周期中金属性最强的元素,则B为Na;结合原子序数可知,C、D、E、F都处于第三周期,C是同周期中阳离子半径最小的元素,则C为Al;D元素的最高价氧化物对应水化物与B元素的最高价氧化物对应水化物反应的产物M是制备木材防火剂的原料,则D为Si、M为Na2SiO3;E的最外层电子数与内层电子数之比为3:5,则最外层电子数为6,故E为硫元素,F的原子序数最大,故F为Cl,据此解答.
解答 解:A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A的最外层电子数是次外层电子数2倍,A原子只能有2个电子层,最外层电子数为4,则A为碳元素;B是短周期中金属性最强的元素,则B为Na;结合原子序数可知,C、D、E、F都处于第三周期,C是同周期中阳离子半径最小的元素,则C为Al;D元素的最高价氧化物对应水化物与B元素的最高价氧化物对应水化物反应的产物M是制备木材防火剂的原料,则D为Si、M为Na2SiO3;E的最外层电子数与内层电子数之比为3:5,则最外层电子数为6,故E为硫元素,F的原子序数最大,故F为Cl.
(1)由上述分析可知,D为Si,故答案为:Si;
(2)F为Cl元素,在元素周期表中的位置为:第三周期ⅦA族,故答案为:第三周期ⅦA族;
(3)元素B和F组成的化合物为NaCl,用电子式表示形成过程: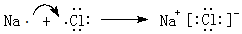 ,
,
故答案为: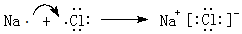 ;
;
(4)Na单质与氧气反应的产物、Al单质同时放入水中,产生两种无色气体,有关的化学方程式为:2Na2O2+2H2O═4NaOH+O2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑,
故答案为:2Na2O2+2H2O═4NaOH+O2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
(5)S2Cl2与水反应生成一种能使品红溶液褪色的气体为二氧化硫,只有一种元素化合价发生改变,故S元素化合价降低,转移0.3mol电子生成二氧化硫为0.1mol,故有0.3molS原子发生还原反应,根据电子转移守恒可知S元素在还原产物中的化合价为0,故生成S,同时生成HCl,该反应的化学方程式为:2S2Cl2+2H2O═3S+SO2↑+4HCl,
故答案为:2S2Cl2+2H2O═3S+SO2↑+4HCl;
(6)某混合物的稀溶液中,只可能含有Na、Al、Cl构成的简单离子或A、E的最高价氧化物对应水化物所电离出来的阴离子CO32-、SO4 2-,现分别取一定体积的该溶液进行实验.两次每次取200.00mL进行实验.
实验1:取2mL溶液,向其中加入AgNO3溶液有沉淀产生,可能含有氯离子、碳酸根离子或硫酸根离子,;
实验2:取200mL溶液,向其中加入足量BaCl2溶液后,产生白色沉淀,说明含有碳酸根离子或硫酸根离子,得干燥沉淀12.54g,沉淀经足量盐酸洗涤、干燥后,剩余4.66g,说明部分沉淀溶于稀盐酸,则该溶液中一定含有碳酸根离子、硫酸根离子,根据离子共存知,一定不存在铝离子,
①根据以上分析知,不能确定溶液中是否存在Cl-、HCO3-,故答案为:Cl-、HCO3-;
②n(BaCO3)=$\frac{12.54g-4.66g}{197g/mol}$mol=0.04mol,n(BaSO4)=$\frac{4.66g}{233g/mol}$mol=0.02mol,根据原子守恒知,溶液中n(SO42-)=0.02mol,n(CO32-)=0.04mol,
根据电荷守恒知,溶液中一定含有钠离子,如果不存在其它阴离子,此时钠离子浓度最小,由电荷守恒可知钠离子最小物质的量为:0.02mol×2+0.04mol×2=0.12mol,故钠离子最小浓度为$\frac{0.12mol}{0.2L}$=0.6mol/L,
故答案为:存在;0.6.
点评 本题以元素推断为载体,考查核外电子排布、元素化合物性质、呈常用化学用语、氧化还原反应、物质推断等,推断元素是解题关键,侧重考查学生运用知识分析问题、解决问题的能力,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
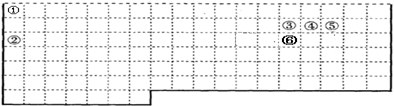
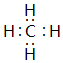 ,上述元素中,能和⑤号元素形成正四面体空间网状结构的化合物的化学式是SiO2.
,上述元素中,能和⑤号元素形成正四面体空间网状结构的化合物的化学式是SiO2. 、
、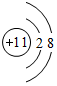 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=-114.6kJ/mol | |
| B. | 由4P(s,红磷)=P4(s,白磷):△H>0可知,白磷的热稳定性比红磷大 | |
| C. | 己知:S(g)+O2(g)=SO2(g);△H1及S(s)+O2(g)=SO2(g):△H2,则△H1<△H2 | |
| D. | 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
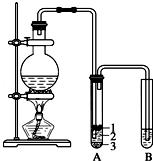 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有自发进行的化学反应都是放热反应 | |
| B. | 熵值增大的反应都能自发进行 | |
| C. | 由能量判据和熵判据组合而成的复合判据,适合于所有的反应 | |
| D. | 同一物质的固、液、气三种状态的熵值相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两溶液一定是等体积混合 | B. | 溶液中:c(R2-)+c(HR-)+c(OH-)=c(Na+)+c(H+) | ||
| C. | 溶液中2c(R2-)+c(HR-)=c(Na+) | D. | 溶液中:c(HR-)>c(Na+)>c(H+)=c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com