

分析 (1)由题目信息可知,氨气与二氧化碳反应生成NH2COONH4;氨基甲酸胺易分解,图中反应装置用冰水冷却,防止氨基甲酸胺分解,说明制备氨基甲酸胺的为放热反应;
(2)根据液体石蜡瓶鼓泡瓶中气泡控制气体流速和原料气体的配比;
(3)由氨基甲酸胺小晶体悬浮在四氧化碳中,可以采取过滤方法分离;
(4)氨基甲酸胺极易水解,产物是碳酸氢铵和一种弱碱,该弱碱为NH3•H2O;
(5)水解反应为吸热反应,升高温度有利于水解进行,对比6~20min内c(NH2CCOO-)变化量越大,水解程度越大,温度越高;
(6)生成的沉淀为碳酸钡,根据碳原子守恒、混合物总质量列方程各自物质的量,再计算氨基甲酸胺的质量,进而计算其质量分数;
(7)①活性炭具有吸附性;
②先通过阴离子交换树脂可能生成Mg(OH)2等沉淀而影响树脂交换效果;
③通过施加一定压力使水分子通过半透膜而将大分子或离子截留,从而获得纯净水的方法称为反渗透法;
④溶液的导电能力取决于溶液中的离子浓度大小,检验蒸馏水的纯度时,最简单的方法是测定水的导电率.
解答 解:(1)由题目信息可知,氨气与二氧化碳反应生成NH2COONH4,反应方程式为:2NH3(g)+CO2(g)?NH2COONH4,
氨基甲酸胺易分解,图中反应装置用冰水冷却,防止氨基甲酸胺分解,说明制备氨基甲酸胺的为放热反应,
故答案为:2NH3(g)+CO2(g)?NH2COONH4;
(2)根据液体石蜡瓶鼓泡瓶中气泡,控制气体流速和调节NH3与CO2通入比例,
故答案为:通过观察气泡,控制气体流速和调节NH3与CO2通入比例;
(3)由氨基甲酸胺小晶体悬浮在四氧化碳中,可以采取过滤方法分离,
故答案为:过滤;
(4)氨基甲酸胺极易水解,产物是碳酸氢铵和一种弱碱,该弱碱为NH3•H2O,反应方程式为:NH2COONH4+2H2O?NH4HCO3+NH3•H2O,
故答案为:NH2COONH4+2H2O?NH4HCO3+NH3•H2O;
(5)6~20min内曲线A中c(NH2CCOO-)减小量大于曲线B的,水解反应为吸热反应,升高温度有利于水解进行,故曲线A的温度高于曲线B的,
故答案为:A;6~20min内曲线A中c(NH2CCOO-)减小量大于曲线B的,水解反应为吸热反应,升高温度有利于水解进行;
(6)生成的沉淀为碳酸钡,其物质的量为$\frac{11.82g}{197g/mol}$=0.06mol,
氨基甲酸铵物质的量为x,碳酸氢铵物质的量为y,
由碳元素守恒可知:x+y=0.06
由质量可得:78x+79y=4.69
解得x=0.05mol,y=0.01mol
故氨基甲酸铵质量为0.05mol×78g/mol=3.9g,其质量分数为$\frac{3.9g}{4.69g}$×100=83.2%,
故答案为:83.2%;
(7)①活性炭具有吸附性,则作用为吸附水中的有机物(或去除异味),
故答案为:吸附水中的有机物(或去除异味);
②A为阳离子交换树脂,B为阴离子交换树脂,交换后硬水中的Ca2+、Mg2+离子,易生成Mg(OH)2等沉淀而影响树脂交换效果,不能交换,
故答案为:不能;否则硬水中的Ca2+、Mg2+离子易生成Mg(OH)2等沉淀而影响树脂交换效果;
③通过施加一定压力使水分子通过半透膜而将大分子或离子截留,从而获得纯净水的方法称为反渗透法,
故答案为:反渗透法;
④因为水的电离程度极小,所以纯水是几乎不导电的,因此要检验蒸馏水的纯度时,最简单易行的方法是测定水的电导率或电阻率,
故答案为:电导率(或电阻率).
点评 本题考查物质制备实验、化学反应速率影响因素、物质含量测定、化学与技术等,属于拼合型题目,把握反应原理为解答的关键,侧重分析与实验能力的考查,综合性较强.


科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Br>Cl>P | B. | 热稳定性:AsH3>PH3 | ||
| C. | 碱性:CsOH>Ca(OH)2 | D. | 酸性:H3AsO4>H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2+H2→NH3 | B. | N2+O2→NO | C. | NO+O2→NO2 | D. | NO2+H2O→HNO3+NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A.用氧化铁作外墙涂料 | B.铸造司母戊鼎 | C.火法炼铜 | D.淘金制饰品 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
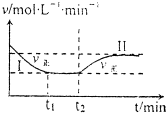 在某一恒温恒容的密闭容器中发生如下反应:3H2(g)+N2(g)?2NH3(g)△H<O.t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如图所示.下列说法正确的是( )
在某一恒温恒容的密闭容器中发生如下反应:3H2(g)+N2(g)?2NH3(g)△H<O.t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如图所示.下列说法正确的是( )| A. | Ⅰ、Ⅱ两过程达到平衡时,平衡常数:KⅠ<KⅡ | |
| B. | Ⅰ、Ⅱ两过程达到平衡时,NH3的体积分数:Ⅰ<Ⅱ | |
| C. | Ⅰ、Ⅱ两过程达到平衡的标志:气体密度不再发生变化 | |
| D. | t2时刻改变的条件可以是向密闭容器中加H2和N2混合气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
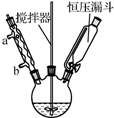 以香豆素3甲酸乙酯(
以香豆素3甲酸乙酯(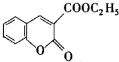 )为原料合成香豆素3甲酸(
)为原料合成香豆素3甲酸(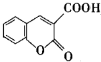 )的装置如图所示,实验步骤如下:
)的装置如图所示,实验步骤如下: +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$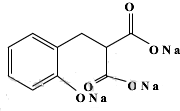 +C2H5OH+H2O.
+C2H5OH+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液 | B. | 酚酞试液 | C. | 硝酸银溶液 | D. | 氯化钡溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com