
| A. | 1.00mol NaCl中含有NA个NaCl分子 | |
| B. | 1.00mol NaCl中,所有Na+的最外层电子总数为8NA | |
| C. | 欲配制1.00L,1.00mol•L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中 | |
| D. | 标准状况下,11.2LCH3CH2OH中含有分子的数目为0.5NA |
分析 A.氯化钠为离子晶体;
B.钠离子是原子失去最外层电子形成,离子最外层电子数是8;
C.溶液的体积大于1L;
D.标况下,乙醇为液体.
解答 解:A.氯化钠为离子晶体,不存在分子,故A错误;
B.Na+的最外层电子电子为8,所以1.00 mol NaCl中,所有Na+的最外层电子总数为8mol,最外层电子总数为8NA,故B正确;
C.将58.5g NaCl溶于1.00L水,溶液的体积大于1L,溶液的浓度小于1.00mol•L-1,故C错误;
D.标况下,乙醇为液体,不能使用气体摩尔体积,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数的应用,熟悉物质的量的有关计算公式,明确气体摩尔体积适用对象和使用条件是解题关键,题目难度不大.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:选择题
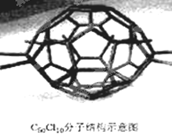
| A. | C70的熔点比石墨的熔点低 | |
| B. | C70和金刚石是同素异形体 | |
| C. | C70分子中含有70个σ键,35个π键 | |
| D. | C70Cl10分子中共用电子对数目为145个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑥②③ | B. | ⑤②③ | C. | ②④⑤ | D. | ①④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 左下方区域的金属元素 | |
| B. | 右上方区域的某些非金属元素 | |
| C. | 金属元素和非金属元素分界线附近的元素 | |
| D. | 过渡元素区域 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
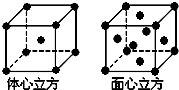 已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示) .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .有机物G(C20H18O4)是一种酯,合成路线如下:
.有机物G(C20H18O4)是一种酯,合成路线如下: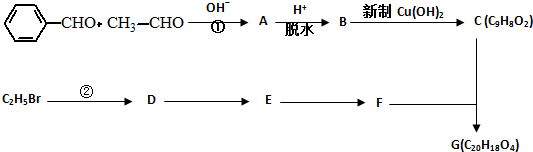
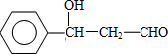 ;F的结构简式:CH2OHCH2OH;
;F的结构简式:CH2OHCH2OH; .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玻璃 纤维素 青霉素 | B. | 石英 橡胶 磷化铟尿素 | ||
| C. | 食盐 聚乙烯 | D. | 涤纶 洗衣粉 阿司匹林 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com