
【题目】A、B、C、D、E是五种短周期元素。已知:它们的原子序数依次增大,A是元素周期表中原子半径最小的元素;B原子最外层电子数比其次外层电子数多2,C是E的邻族元素;D和E的原子序数之和为30,且D的族序数与周期数相等。甲、乙、丙、丁是它们两两形成的化合物,其中甲分子中含有18个电子。
物质组成 | 甲 | 乙 | 丙 | 丁 |
化合物中各元素 原子个数比 | A和C 1:1 | B和A 1:4 | D和E 1:3 | B和E 1:4 |
请回答下列问题:
(1)若元素E的某种核素中中子数比质子数多3个,表示这种核素的符号为____________;
(2)把D的单质放到NaOH溶液中,反应的离子方程式为:_______________________;
(3)用电子式表示甲的形成过程:_____________________________________________;
(4)在密闭容器中充入BC2、BC和乙的混合气体共mg,若加入足量Na2O2,并不断用电火花点燃至反应完全,测得固体质量增重mg,则BC2与乙的质量比为________________;
(5)有100mL MgCl2和丙的混合溶液,其中c(Mg2+)= 0.2 mol· L-1,c(Cl-)= 1.3mol·L-1,要使Mg2+全部转化为沉淀分离出来,至少需要4 mol·L-1 NaOH 溶液的体积是:____________mL。
【答案】![]() 2Al+2OH-+2H2O = 2AlO2-+3H2↑
2Al+2OH-+2H2O = 2AlO2-+3H2↑ ![]() 11:4 40
11:4 40
【解析】
A是元素周期表中原子半径最小的元素,则A是氢元素;B原子最外层电子数比其次外层电子数多2,则B是碳元素;由A、B、C、D、E的原子序数依次增大,D的族序数与周期数相等可知,D为Al元素;由D和E的原子序数之和为30,可知E的原子序数为17,则E为Cl元素;由C是Cl的邻族元素,能够与氢元素形成原子个数比为1:1含有18个电子的分子可知,C是O元素,由原子个数比可知甲为双氧水、乙为甲烷、丙为氯化铝、丁为四氯化碳。
(1)Cl元素的质子数为17,中子数比质子数多3个的核素的质量数为37,种核素的符号3717Cl,故答案为:3717Cl;
(2)D为Al元素,铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式为2Al+2OH-+2H2O = 2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O = 2AlO2-+3H2↑;
(3)2个氢原子和1个氧原子通过共价键形成共价化合物过氧化氢,用电子式表示过氧化氢的形成过程为![]() ,故答案为:
,故答案为:![]() ;
;
(4)入BC2为CO2,BC为CO,乙为CH4,由2CO2+2Na2O2═2Na2CO3+O2可知,固体增重为与CO2等物质的量的CO的质量,由2Na2O2+2H2O=4NaOH+O2,可知固体增重为与H2O等物质的量的H2的质量,在密闭容器中充入CO2、CO、CH4的混合气体共mg,若加入足量的Na2O2,充分振荡并不断用电火花引燃至反应完全,测得固体质量增加mg,则系列反应后CO2、CO、CH4混合气体中所有元素均被吸收,故原混合物中CO2与CH4相当于CO、H2混合,则CO2与CH4的体积之比为1:1,质量比为44:16=11:4,故答案为:11:4;
(5)丙为氯化铝,100mL MgCl2和AlCl3的混合溶液,其中n(Mg2+)= 0.02 mol,n(Cl-)=0.13mol,由电荷守恒可知3n(Al3+)+2n(Mg2+)=n(Cl-),n(Al3+)=![]() =0.03mol;使Mg2+全部转化为沉淀分离出来时,得到氯化钠和偏铝酸钠混合溶液,由电荷守恒可得n(Na+)=n(Cl-) +n(AlO2—),4 mol·L-1× V(NaOH)=0.13mol+0.03mol,解得V(NaOH)=0.04L=40ml,故答案为:40。
=0.03mol;使Mg2+全部转化为沉淀分离出来时,得到氯化钠和偏铝酸钠混合溶液,由电荷守恒可得n(Na+)=n(Cl-) +n(AlO2—),4 mol·L-1× V(NaOH)=0.13mol+0.03mol,解得V(NaOH)=0.04L=40ml,故答案为:40。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4+6HCHO===3H++6H2O+(CH2)6N4H+[滴定时,1 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸.某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ 称取样品1.500 g。
步骤Ⅱ 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积________(填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察____________________。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由______色变成____________色。
(2)滴定结果如下表所示:
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.20 | 20.20 |
若NaOH标准溶液的浓度为0.1010 mol/L,则该样品中氮的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101kPa条件下,反应2N2O5(g)=4NO2(g)+O2(g) ΔH=+56.7 kJ·mol-1能自发进行的原因是( )
A. 该反应是吸热反应B. 该反应是放热反应
C. 该反应是熵减小的反应D. 该反应的熵增效应大于能量效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+Br2(g)=2HBr(g)ΔH=-Q kJmol-1,其他相关数据如下表:则Q的值为( )
H2(g) | Br2(g) | HBr(g) | |
1 mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | 200 | 369 |
A. 102B. 260C. 230D. 404
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油是工业的血液,通过它可以得到很多重要的化工产品。
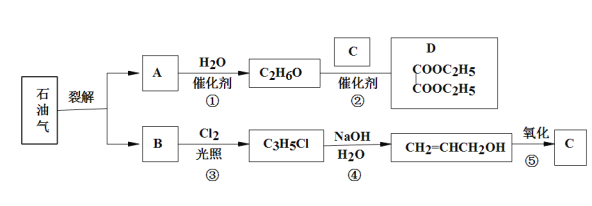
已知: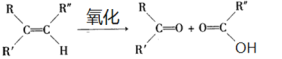
(1)B和A为同系物,B的结构简式为___________,其含有的官能团名称为__________;
(2)反应①的化学方程式为__________________________,其反应类型为______________;
(3)写出检验C3H5Cl中含有Cl原子的方法________________________________________;
(4)C的结构简式为_________________;
(5)反应④的化学方程式为____________________________________________________;
(6)设计一条由乙烯为原料制备D的合成路线(其他无机原料任选)______。合成路线流程图示例如下:![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 碳酸钙与盐酸反应:CO32++2H+=H2O+CO2↑
B. 将氯气溶于水制备次氯酸:Cl2+H2O =H++Cl-+HClO
C. 氢氧化钡溶液与稀H2SO4 反应:Ba2++SO42-=BaSO4↓
D. 氯化亚铁溶液中通入氯气:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列叙述错误的是
A. 18g H2O中含的质子数为10NA
B. 12g 金刚石含有的共价键数为4NA
C. 28g N2中含有π键总数为2NA
D. 1 mol Na 与足量O2 反应,生成Na2O和Na2O2的混合物,钠失去NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫煤燃烧会产生大气污染物,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是( )

A. 该过程中可得到化工产品H2SO4
B. 该过程中化合价发生改变的元素为Fe和S
C. 该工艺流程是除去煤燃烧时产生的SO2
D. 图中涉及的反应之一为Fe2(SO4)3+SO2 + 2H2O=2FeSO4+2H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体d呈喷泉状喷出,最终几乎充满烧瓶。则a和b分别是
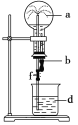
a(干燥气体) | b(液体) | |
A | NO | 水 |
B | CO2 | 4 mol/L NaHCO3溶液 |
C | Cl2 | 饱和NaCl水溶液 |
D | NH3 | 1 mol/L盐酸 |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com