
分析 (1)亚铁离子在水溶液中呈浅绿色;氢氧化亚铁和空气中氧气、水蒸气反应生成氢氧化铁;
(2)①向盛有NaOH溶液的试管中加入少量FeS04溶液应生成白色沉淀;
②己知胶体粒子的吸附能力随温度升高而下降,升温,吸附的亚铁离子进入溶液,灰绿色沉淀应变化为白色沉淀.
解答 解:(1)亚铁离子在水溶液中呈浅绿色,氢氧化亚铁和空气中氧气、水蒸气反应生成氢氧化铁,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:浅绿色;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(2)认为白色沉淀迅速变为灰绿色的原因是Fe(OH)2凝胶吸附了溶液中过量的Fe2+离子,
①向盛有NaOH溶液的试管中加入少量FeS04溶液,亚铁离子少全部转化为氢氧化亚铁,若该观点正确,应观察到的现象是无灰绿色出现,只有白色沉淀生成,
故答案为:析出白色沉淀;
②己知胶体粒子的吸附能力随温度升高而下降.向盛装FeSO4溶液的试管中滴加少量NaOH溶液,析出白色沉淀,沉淀迅速变为灰绿色,将此试管小心加热,吸附的亚铁离子离开沉淀,所以若观察到灰绿色沉淀变化为白色沉淀,说明上述解释成立,
故答案为:灰绿色沉淀变化为白色.
点评 本题考查了铁及其化合物性质的分析,主要是反应现象的解释和证明,注意题干信息的应用,题目较简单.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大反应物浓度,可增大活化分子百分数,从而使有效碰撞次数增多 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能使反应速率增大,主要原因是增加了反应物分子浓度 | |
| D. | 使用正催化剂能增大活化分子百分数,从而显著地增大化学反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
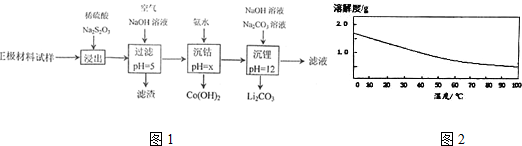
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)3 |
| 开始沉淀的pH | 3.1 | 7.1 | 2.2 |
| 完全沉淀的pH | 4.7 | 9.7 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,关于阿司匹林的叙述正确的是( )
,关于阿司匹林的叙述正确的是( )| A. | 阿司匹林属于抗生素 | |
| B. | 阿司匹林不能发生水解反应 | |
| C. | 阿司匹林具有解热镇痛作用 | |
| D. | 阿司匹林之所以成为经典药物是因为服用该药物没有不良反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磷酸的摩尔质量与阿伏加德罗常数(NA)个磷酸分子的质量在数值上相等 | |
| B. | 常温常压下,0.5NA个CO分子所占体积是11.2L | |
| C. | 1molNH4+中含有的电子数为10NA | |
| D. | 1L0.3mol/L的Na2SO4溶液中,含有Na+和 SO42-总数为0.9 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 称取5 g左右的干海带--托盘天平 | |
| B. | 过滤煮沸后的海带灰和水的混合物--漏斗 | |
| C. | 用蒸发结晶的方法从氧化后的海带灰浸取液中提取碘--蒸发皿 | |
| D. | 用四氯化碳从氧化后的海带灰浸取液中提取碘--长颈漏斗 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com