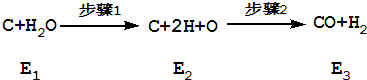【答案】分析:A.根据化学键断裂形成原子需要吸收能量,原子之间形成化学键放出能量;
B.根据放热过程生成物的总能量小于反应物总能量,吸热过程生成物的总能量高于反应物总能量,结合炭和水蒸汽发生反应生成CO、H2为放热反应判断;
C.根据反应热等于生成物的总能量-反应物的总能量,然后根据物质的物质的量与反应热的关系计算;
D.根据吸热反应中化学键断裂形成原子需要吸收能量大于原子之间形成化学键放出能量.
解答:解:A.①步骤l中化学键断裂形成原子,应是吸热过程,步骤2是原子之间形成化学键生成新物质,放出热量,故A正确;
B.步骤1为吸热过程,故E2>E1,步骤2是放热过程,故E2>E3,由于炭和水蒸汽发生反应生成CO、H2为吸热反应,故E1>E3,故E2>E1>E3,故B错误;
C.炭和水蒸汽发生反应生成CO和H2:C+H2O=CO+H2△H=(E3-E1)kj/mol,1mol C发生该反应时吸收的能量为E3-E1,故C正确;
D.炭和水蒸汽发生反应生成CO、H2是吸热反应,所以反应中化学键断裂形成原子需要吸收能量大于原子之间形成化学键放出能量,即E2-E1>E2-E3,故D错误;
故选BD.
点评:本题主要考查了化学反应中的能量变化的原因,难度不大,注意基础知识的理解掌握.



 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案