
| A. | ②③ | B. | ①⑥ | C. | ④⑥ | D. | ⑤⑥ |
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 铍原子的半径小于硼原子的半径 | |
| B. | 相同条件下,单质铍与酸反应比单质锂与酸反应剧烈 | |
| C. | 氢氧化铍的碱性比氢氧化钙的碱性弱 | |
| D. | 单质铍能与冷水剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
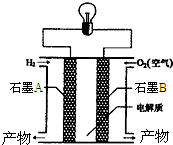 氢氧燃料电池是一种能在航天飞机上使用的特殊电池,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )
氢氧燃料电池是一种能在航天飞机上使用的特殊电池,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )| A. | B电极上发生氧化反应 | |
| B. | A电极是负极 | |
| C. | 该电池的总反应为2H2+O2=2H2O | |
| D. | 外电路中电子由A电极通过导线流向B电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF MgCl2 NH4Cl | B. | H2S Na2O ? CO2 | ||
| C. | CaCl2 ? NaOH C H4 | D. | NH3 H2O CS2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当5NA个电子转移时,该反应放出650 kJ的热量 | |
| B. | 当1NA个水分子生成且为气体时,放出多于1300 kJ的热量 | |
| C. | 当2 NA个碳氧双键生成时,放出1300 kJ的热量 | |
| D. | 当4NA个碳氧共用电子对生成时,放出1300kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF、H2O的沸点比HCl、H2S的沸点高很多 | |
| B. | 正戊烷的沸点比新戊烷的沸点高 | |
| C. | 邻羟基苯甲酸的沸点比对羟基苯甲酸的低 | |
| D. | Na2O的熔点比MgO的熔点低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HAt很稳定 | B. | 砹易溶于某些有机溶剂 | ||
| C. | AgAt不溶于水 | D. | 砹是有色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

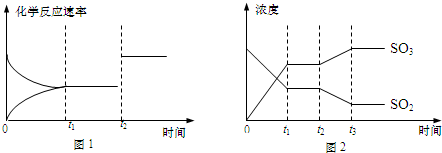
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com