
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:解答题
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 如图所示的反应为放热反应 | |
| B. | 化学反应中有物质变化也有能量变化 | |
| C. | 化学反应具有方向性 | |
| D. | 化学键断裂吸收能量,化学键生成放出能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
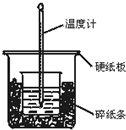 通过测定反应过程中所放出的热量可计算中和热.50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在图示的装置中进行中和反应.回答下列问题:
通过测定反应过程中所放出的热量可计算中和热.50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在图示的装置中进行中和反应.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用大理石跟稀盐酸制二氧化碳:CO32-+2H+═H2O+CO2↑ | |
| B. | 向氢氧化钡溶液中加硫酸溶液:SO42-+Ba2+=BaSO4↓ | |
| C. | 硫酸溶液中加入Mg (OH)2:2H++2OH-=2H2O | |
| D. | 澄清石灰水与盐酸的反应:H++OH-=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(X)=0.005 mol•L-1•s-1 | B. | v(Z)=0.01 mol•L-1•s-1 | ||
| C. | v(Y)=0.01 mol•L-1•s-1 | D. | v(M)=0.025 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡不会发生移动 | B. | SO3的质量分数增大 | ||
| C. | 混合气体的密度减小 | D. | 混合气体的平均相对分子质量不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com