
【题目】将5.1g镁铝合金溶于600mL0.5mol·L-1H2SO4溶液中,完全溶解后再加入1.0mol·L-1的NaOH溶液,得到沉淀的质量为13.6g,继续滴加NaOH溶液时则沉淀会减少。
(1)当加入__mLNaOH溶液时,可使溶解在硫酸中的Mg![]() 和Al
和Al![]() 恰好完全沉淀。
恰好完全沉淀。
(2)计算合金溶于硫酸时所产生的氢气在标准状况下的体积。(列出算式)___
【答案】600 5.6L
【解析】
固体完全溶解,生成MgSO4和Al2(SO4)3,依据极值法分析,可确定硫酸有剩余。加入NaOH后,首先与过量的硫酸反应,然后才与MgSO4和Al2(SO4)3反应。当MgSO4和Al2(SO4)3刚好完全反应时,生成Mg(OH)2、Al(OH)3、Na2SO4。
(1)溶解在硫酸中的Mg![]() 和Al
和Al![]() 恰好完全沉淀时,溶液中的溶质为Na2SO4,由此可得出
恰好完全沉淀时,溶液中的溶质为Na2SO4,由此可得出
n(NaOH)=2n(H2SO4)=2×0.600L×0.5mol·L-1=0.6mol,V(NaOH)=![]() 。
。
(2)Mg、Al在反应过程中,存在下列关系式:Mg—H2—Mg(OH)2—2OH-,2Al—3H2—2Al(OH)3—6OH-,综合分析两关系式,可得出H2—2OH-。通过沉淀与金属的质量相减,便可求出m(OH-),由此可求出生成H2的体积。
(1)溶解在硫酸中的Mg![]() 和Al
和Al![]() 恰好完全沉淀时,溶液中的溶质为Na2SO4,由此可得出
恰好完全沉淀时,溶液中的溶质为Na2SO4,由此可得出
n(NaOH)=2n(H2SO4)=2×0.600L×0.5mol·L-1=0.6mol,V(NaOH)=![]() =0.6L=600mL。答案为:600;
=0.6L=600mL。答案为:600;
(2)Mg、Al在反应过程中,存在下列关系式:Mg—H2—Mg(OH)2—2OH-,2Al—3H2—2Al(OH)3—6OH-,综合分析两关系式,可得出H2—2OH-。
m(OH-)=13.6g-5.1g=8.5g,n(OH-)=![]() ,n(H2)=
,n(H2)=![]() n(OH-)=0.25mol,
n(OH-)=0.25mol,
V(H2)= 0.25mol×22.4L/mol=5.6L。答案为:5.6L。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】工业上利用软锰矿(主要成分为MnO2,同时含少量铁、铝等的化合物)制备硫酸锰的常见流程如下:
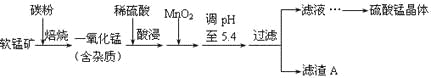
部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
pH | 5.2 | 3.2 | 9.7 | 10.4 |
(1)一氧化锰用硫酸酸浸时发生的主要反应的离子方程式为____________________。酸浸后加入MnO2将溶液中的Fe2+氧化成Fe3+,其目的是___________。
(2)滤渣A的成分除MnO2外,还有_______________。
(3)MnO2是制造碱性锌锰电池的基本原料,放电时负极的电极反应式为________。工业上以石墨为电极电解酸化的MnSO4溶液生产MnO2,阳极的电极反应式为_________,当阴极产生4.48L(标况)气体时,MnO2的理论产量为______g。
(4)锰的三种难溶化合物的溶度积:Ksp(MnCO3)=1.8×10-11,Ksp[Mn(OH)2]=1.9×10-13,Ksp(MnS)=2.0×10-13,则上述三种难溶物的饱和溶液中,Mn2+浓度由大到小的顺序是_______>_______>_______(填写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在固定容积的密闭容器中,可逆反应:mA(g)+nB(g)![]() pCg)+qD(g),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化,②体系的密度不再发生变化,③各组分的物质的量浓度不再改变,④各组分的质量分数不再改变,⑤反应速率vA:vB:vC:vD=m:n:p:q,其中,能说明反应已达到平衡的是( )
pCg)+qD(g),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化,②体系的密度不再发生变化,③各组分的物质的量浓度不再改变,④各组分的质量分数不再改变,⑤反应速率vA:vB:vC:vD=m:n:p:q,其中,能说明反应已达到平衡的是( )
A.只有③④B.②③④C.①②③④D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(![]() )为一元弱酸,广泛用于玻璃、医药、冶金、皮革等工业。回答下列问题:
)为一元弱酸,广泛用于玻璃、医药、冶金、皮革等工业。回答下列问题:
(1)![]() 中B元素的化合价为______。
中B元素的化合价为______。
(2)已知:![]() ,
,![]() 的电离方程式为____,酸性:
的电离方程式为____,酸性:![]() ___(填“>”或“<”)
___(填“>”或“<”)![]() 。
。
(3)![]() 受热分解得到
受热分解得到![]() ,
,![]() 和镁粉混合点燃可得单质B,写出生成单质B的化学方程式________,该反应中氧化剂和还原剂物质的量之比为______。
和镁粉混合点燃可得单质B,写出生成单质B的化学方程式________,该反应中氧化剂和还原剂物质的量之比为______。
(4)![]() 可用于生产储氢材料NaBH4。涉及的主要反应为:
可用于生产储氢材料NaBH4。涉及的主要反应为:
Ⅰ.![]()
Ⅱ.![]()
①“反应Ⅰ”的类型为______(填标号)。
a.取代反应 b.加成反应 c.加聚反应 d.氧化反应
②NaH的电子式为____________。
③在碱性条件下,NaBH4与CuSO4溶液反应可得Cu和![]() ,其中H元素由
,其中H元素由![]() 价升高为
价升高为![]() 价,该反应的离子方程式为______。
价,该反应的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)制备铁红(Fe2O3)的生产流程如下:
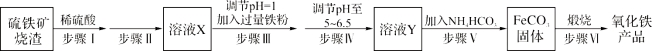
试回答下列问题:
(1)步骤Ⅰ所得溶液中铁元素的化合价是 。
(2)实验室中实现步骤Ⅱ中分离操作需要的仪器有 、铁架台、玻璃棒、烧杯。
(3)步骤Ⅲ中发生的离子方程式 ,向反应后的溶液中加入试剂 ,当观察到 说明步骤Ⅲ已经进行完全。
(4)步骤Ⅳ中不能选用试剂 调节溶液的pH(填字母编号)。
a.FeO固体 b.氢氧化钠溶液 c.Fe2O3固体 d.氨水
(5)室温下FeCO3达到溶解平衡时溶液pH=8.5,c(Fe2+)=1.2×10-6 mol·L-1。则FeCO3固体产物中 (选填“有”或“无”)Fe(OH)2。(已知:Ksp[Fe(OH)2]=4.8×10-16)
(6)步骤Ⅵ中发生反应的化学反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业甲醇的质量分数可以用下列方法测定:
①在稀H2SO4中甲醇被Cr2O72—氧化成CO2和H2O,
反应式为:CH3OH+Cr2O72—+8H+=CO2↑+2Cr3++6H2O;
②过量的Cr2O72—可用Fe2+与之完全反应:
___Cr2O72—+___Fe2++____H+—_____Cr3++____Fe3++____H2O
现有0.12 g工业甲醇,在H2SO4溶液中与25 mL 0.2 mol·L-1K2Cr2O7溶液反应,多余的K2Cr2O7再用1 mol·L—1FeSO4与其反应,结果用去FeSO4溶液9.6 mL。
(1)配平第②步的离子方程式。
(2)计算工业甲醇的质量分数_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是

A. 向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B. 实验中装置b中的液体逐渐变为浅红色
C. 装置c中的碳酸钠溶液的作用是吸收溴化氢
D. 反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的原子序数是其最外层电子数的三倍,下列说法正确的是( )
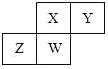
A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性:Z>W>X
C.最简单气态氢化物的热稳定性:Y>X>W>Z
D.元素X、Y、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是在实验室进行氨气快速制备与性质实验的组合装置,部分固定装置未画出。
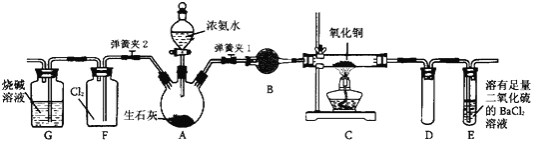
(1)在组装好装置后,若要检验A~E装置的气密性,其操作是首先____,然后微热A,观察到E中有气泡冒出,移开酒精灯或松开双手,E中导管有水柱形成,说明装置气密性良好。
(2)装置B中盛放的试剂是________。
(3)点燃C处酒精灯,关闭弹簧夹2,打开弹簧夹l,从分液漏斗放出浓氨水至浸没烧瓶中固体后关闭分液漏斗,稍候片刻,装置C中黑色固体逐渐变红,装置E中溶液里出现大量气泡,同时还可能产生的现象是________;从E中逸出液面的气体可以直接排入空气,请写出在C中发生反应的化学方程式:________。
(4)当C中固体全部变红色后,关闭弹簧夹1,慢慢移开酒精灯,待冷却后,称量C中固体质量,若反应前固体质量为16 g,反应后称重固体质量减少2.4 g,通过计算确定该固体产物的成分是________(用化学式表示)。
(5)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,很快发现装置F中产生白烟,同时发现G中溶液迅速倒吸流入F中。请写出产生白烟的化学方程式:________,迅速产生倒吸的原因是________。
(6)为了汪明一水合氨是弱碱,甲、乙两同学分别设计以下实验进行探究。
①甲同学用pH试纸测得室温下0.l mol/L氨水pH为10,则认定一水合氨是弱电解质,理由是________。
②乙同学取出10 mL 0.1 mol/L氨水,滴入2滴酚酞试液,显粉红色,再加入NH4Cl晶体少量,观察到的现象是________,则证明一水台氨是弱电解质。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com