
氧可与许多元素形成化合物,下列有关叙述错误的是
A.氧与氟形成的化合物分子式为OF2
B.次氯酸分子的结构式为H-Cl-O
C.Na2O2的电子式为![]()
D.在MgO晶体中,O2-的结构示意图可表示为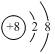
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省漳州市八校高三第三次联考理综化学试卷(解析版) 题型:填空题
VA族的氮、磷、砷(As)等元素的化合物在科研和生产中有许多重要用途,请回答下列问题。
(1)砷的基态原子的电子排布式为????????????? 。
(2)N、P、As原子的第一电离能由大到小的顺序为????????????? 。
(3)NH3的沸点比PH3高,原因是? ??????????????????????????????? ????????? ;PO43-离子的立体构型为?????????????? 。
(4)PH3分子中P原子采用????? 杂化。
(5)H3AsO4和H3AsO3是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比H3AsO3 酸性强的原因????????????? ?????????????????? ????????????? 。
(6)CuCl2与氨水反应可形成配合物[Cu(NH3)4]Cl2,1mol该配合物中含有σ键的数目为??????????? 。
查看答案和解析>>
科目:高中化学 来源:2014届福建省高二下学期期末联考化学试卷(解析版) 题型:填空题
氧族元素的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含氧族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1) S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是 。

(2)Se原子在元素周期表中位置为 ;
其基态原子核外价电子的轨道表示式为 。
(3)气态SeO3分子的立体构型为 。
(4)H+可与H2O形成H3O+,H3O+中存在的共价键类型为: 。H3O+中H—O—H键角比H2O中H—O—H键角大,原因为_____________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)根据提供的信息写出相应的化学方程式:
1-1 据认为“红巨星”星体内部发生着合成重元素的中子俘获反应,例如![]() Zn可以俘获1个中子形成A,过剩的能量以光子形式带走;A发生β衰变转化为B。
Zn可以俘获1个中子形成A,过剩的能量以光子形式带走;A发生β衰变转化为B。
试写出平衡的核反应方程式。
1-2 铍与某些普通配体形成的配合物相当稳定,比如铍的化合物A为无色可升华的分子型化合物,易溶于氯仿并可从氯仿溶液中重结晶。A物质中心氧原子周围按四面体方式排布4个Be原子,Be原子两两间又被醋酸根所桥联。该物质可以通过碳酸铍与醋酸反应制备,请写出该制备反应的化学方程式;
1-3 ClF3是比F2更有效的氟化剂,遇有机物往往爆炸,能燃烧石棉,能驱除许多金属氧化物中的氧。比如气态ClF3与Co3O4反应,作为还原剂的元素有两种,物质的量之比为14,请写出反应方程式。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com