
(9分)(1)在反应K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O中, ___元素被氧化,____元素被还原, 是氧化剂; 是还原产物(填相应的元素符号或化学式);若标准状况下产生2.24L Cl2,则电子转移的总数是 NA.
(2)某强酸性反应体系中,反应物和生成物共六种物质:O2、MnO4-、H2O 、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2 →O2。
①写出该未配平的离子方程式 。
②如果上述反应中有11.2L(标准状况)气体生成,则被还原的物质为 mol。
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 2SO3(g) 测得开始时,SO2、O2、和SO3的浓度分别为0.2mol?L-1、0.1mol?L-1、0.2mol?L-1,在反应过程中不断测该容器中各物质的浓度,下列测定数据肯定不正确的是( )
2SO3(g) 测得开始时,SO2、O2、和SO3的浓度分别为0.2mol?L-1、0.1mol?L-1、0.2mol?L-1,在反应过程中不断测该容器中各物质的浓度,下列测定数据肯定不正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
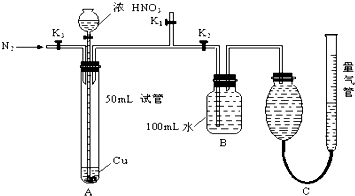
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com