
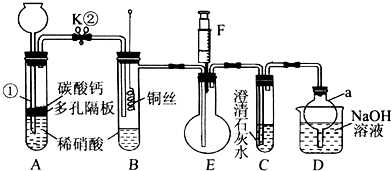
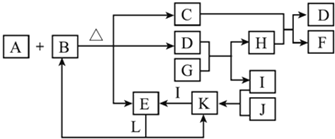
分析 由实验装置及流程可知,A中发生硝酸与碳酸钙的反应生成二氧化碳,因烧瓶中有空气,则生成的NO能与氧气反应生成二氧化氮,利用A装置反应生成的二氧化碳气体赶净装置中的空气避免对一氧化氮气体检验的干扰;B中发生Cu与硝酸的反应生成NO、硝酸铜,E中收集到无色气体NO,利用F充入空气,可检验NO的生成;C装置可检验二氧化碳充满B、E装置;D装置为尾气处理装置,吸收氮的氧化物,防止污染空气,
(1)通过气体发生器与液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置气密性的好坏;
(2)因烧瓶中有空气,则生成的NO能与氧气反应生成二氧化氮,利用A装置反应生成的二氧化碳气体赶净装置中的空气避免对一氧化氮气体检验的干扰;
(3)铜与稀硝酸反应生成Cu2+和NO气体,NO无色,铜离子为蓝色,将装置B中铜丝插入稀硝酸并微热,观察到装置B中铜丝上产生气泡,溶液逐渐变蓝;
(4)无色的NO遇空气被氧化成红色的NO2,可以通过这一点检验NO;
(5)极易溶于水的气体,若吸收时导管伸入水中,由于气体溶于水,导致装置内压强急剧降低,外界大气压压着液体进入,产生倒吸现象,倒扣的漏斗,球形部分空间大,可防止倒吸.
解答 解:(1)利用压强差检查装置A的气密性,具体操作为:关闭K,向长颈漏斗中加水至漏斗下端中形成一段液柱,静置一段时间,若液面高度保持不变,则气密性良好,
故答案为:关闭K,向长颈漏斗中加水至漏斗下端中形成一段液柱,静置一段时间,若液面高度保持不变,则气密性良好;
(2)因NO与氧气反应发生2NO+O2=2NO2,生成红棕色的二氧化氮气体,为排除对实验的影响,利用生成的CO2将整套装置内的空气赶尽,以排除对Cu与稀HNO3反应生成的气体产物观察的干扰,当装置C中产生白色沉淀时,可停止通入二氧化碳,
故答案为:利用生成的CO2气体将装置中的空气除尽;打开K,将CO2气体通入至C中产生白色沉淀时,关闭K;
(3)因铜与稀硝酸反应生成硝酸铜、NO和水,其离子反应为3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O,NO无色,铜离子为蓝色,观察到气泡冒出和溶液变为蓝色,
故答案为:铜丝上产生气泡,溶液逐渐变蓝;3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(4)将F中的空气推入E中,发生2NO+O2=2NO2,E中无色气体变为红棕色,证明NO存在,则装置E和F的作用是验证NO的生成,
故答案为:验证无色气体为NO;推动注射器,将F中空气通入E中,无色气体变红;
(5)NO、NO2都有毒,能污染环境,氮的氧化物能被NaOH溶液吸收,装置D的作用为吸收多余的氮氧化物,防止污染空气,D部分仪器a为倒扣的漏斗,球形部分空间大,可防止倒吸,
故答案为:防止液体倒吸.
点评 本题考查性质实验方案的设计,为高频考点,把握实验装置的作用、发生的反应及NO易被氧化为解答的关键,侧重分析能力与实验能力的综合考查,题目难度中等.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:解答题
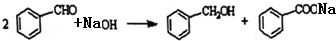
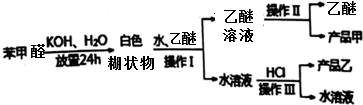
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
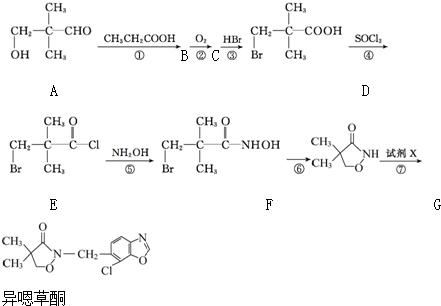
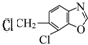 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
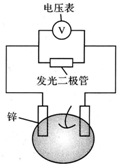 留心处处皆学问.从生活出发进行科学探究,可以获得自信,形成正确的思维方式.甲、乙两位同学一起合作设计完成了水果电池的实验(如图),测得数据如下
留心处处皆学问.从生活出发进行科学探究,可以获得自信,形成正确的思维方式.甲、乙两位同学一起合作设计完成了水果电池的实验(如图),测得数据如下| 实验序号 | 电极材料 | 水果种类 | 电极间距离/cm | 电压/mV |
| 1 | 锌铜 | 菠萝 | 3 | 900 |
| 2 | 锌铜 | 苹果 | 3 | 650 |
| 3 | 锌铜 | 柑橘 | 3 | 850 |
| 4 | 锌铜 | 西红柿 | 3 | 750 |
| 5 | 锌铝 | 菠萝 | 3 | 650 |
| 6 | 锌铝 | 苹果 | 3 | 450 |
| 甲同学 | 乙同学 | |
| A | 实验6中负极电极反应式如何写? | Al-3e-=Al3+ |
| B | 实验1,5中电流方向为什么相反? | 1中锌为负极,电流由铜经导线流向锌,5中铝为负极,铝失去电子,电流由锌经导线流向铝 |
| C | 水果电池的电压与哪些因素有关? | 只跟水果的类型有关 |
| D | 实验中发光二极管不亮,如何使它亮起来 | 可用铜锌作电极,用菠萝作介质,并将多个此电池串联起来 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
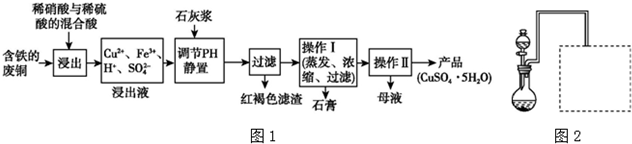
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
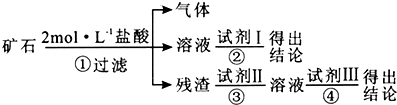
| 编号 | 实验操作 | 预期现象和结论 |
| ① | 取适量矿石研细,加 足量2 mol•L-1盐酸 | 有大量无色气体生成,得棕黄 色溶液,且仍有少量固体残留 |
| ② | ||
| ③ | ||
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na | B. | Mg | C. | Al | D. | Zn |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com