
 H++CO32-,电离出的CO32-和Ca2+结合生成了CaCO3沉淀,促进HCO3-的电离,平衡正向移动;
H++CO32-,电离出的CO32-和Ca2+结合生成了CaCO3沉淀,促进HCO3-的电离,平衡正向移动; H++CO32-,电离出的CO32-和Ca2+结合生成了CaCO3沉淀,减少了CO32-离子浓度,促使HCO3-的电离平衡向右移动,增大了H+的浓度,生成HClO,
H++CO32-,电离出的CO32-和Ca2+结合生成了CaCO3沉淀,减少了CO32-离子浓度,促使HCO3-的电离平衡向右移动,增大了H+的浓度,生成HClO, H++CO32-,电离出的CO32-和Ca2+结合生成了CaCO3沉淀,减少了CO32-离子浓度,促使HCO3-的电离平衡向右移动,增大了H+的浓度,生成HClO;
H++CO32-,电离出的CO32-和Ca2+结合生成了CaCO3沉淀,减少了CO32-离子浓度,促使HCO3-的电离平衡向右移动,增大了H+的浓度,生成HClO;

科目:高中化学 来源: 题型:

| A、双酚A的相对分子质量为228 |
| B、双酚A的核磁共振氢谱显示氢原子数之比为1:2:2:3 |
| C、反应①中,1mol双酚A最多消耗2mol Br2 |
| D、反应②的产物只有一种官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、CuFeS2中只有硫元素被氧化 |
| B、每生成1mol SO2,反应中转移6mol电子 |
| C、该反应中有两种物质作氧化剂 |
| D、CuFeS2中被氧化和被还原的原子数之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯的硝化、丙烯使高锰酸钾酸性溶液褪色的反应都属于取代反应 |
| B、C8H10含苯环的烃同分异构体有3种 |
| C、乙烯、苯、乙烷分子中的所有原子都在同一平面上 |
D、莽草酸( )能使溴的四氯化碳溶液褪色 )能使溴的四氯化碳溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向1 mo1?L-l CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高 | ||||||||||
B、25℃时,将a mo1?L-l氨水与0.01 moI?L-1盐酸等体积混合,反应完全时溶液中Kb=
| ||||||||||
C、根据下表数据可以计算出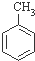 (g)+3H2(g)→ (g)+3H2(g)→ (g)的焓变 (g)的焓变
| ||||||||||
| D、已知298K时,MgCO3的Ksp=6.82×10-6,溶液中c(Mg2+)=0.0001 mol?L-1,c(CO32-)=0.0001 mol?L-1,此时Mg2+和CO32-不能共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、先后通入溴水和澄清的石灰水 |
| B、点燃后罩上涂有澄清石灰水的烧杯 |
| C、点燃后罩上涂有澄清石灰水的烧杯,通入溴水 |
| D、点燃,先后罩上干燥的冷烧杯和涂有澄清石灰水的烧杯 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com