
 X是一种重要的工业原料,X在160℃分解制备异氰酸和氨气,反应方程式为:X
X是一种重要的工业原料,X在160℃分解制备异氰酸和氨气,反应方程式为:X| 160℃ |
| △c |
| △t |
| 1 |
| 2 |
| ||
| 20min |
| 1 |
| 2 |
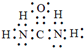 ,故答案为:
,故答案为: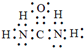 ;
;

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
| A、若混合后溶液呈中性,则有c(Cl-)=c(NH4+) |
| B、用湿润的pH试纸测定两溶液的pH时,氨水的误差更小 |
| C、若混合后溶液呈中性,则所需氨水的体积小于盐酸的体积 |
| D、两溶液等体积混合时,充分反应后:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、X和Y均为中学常见物质,其中A、B为单质,X、Y为化合物,C为地壳中含量最多的元素形成的单质,它们在一定条件下可发生如图反应,请填空:
A、B、C、X和Y均为中学常见物质,其中A、B为单质,X、Y为化合物,C为地壳中含量最多的元素形成的单质,它们在一定条件下可发生如图反应,请填空:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、少量二氧化碳通入Ba(OH)2溶液中:CO2+OH-=HCO3- |
| B、向Ba(OH)2溶液逐滴加入稀硫酸:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| C、向双氧水中通入SO2:SO2+H2O2=2H++SO42- |
| D、锌与稀硫酸反应:Zn+4H++SO42-=Zn2++SO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,2.24L CO和CO2混合气体中含有的碳原子数目为0.1NA |
| B、100ml 18.4mol/L的浓硫酸与足量铜加热充分反应后生产SO2的数目为0.92NA |
| C、密闭容器中盛有0.1mol N2和0.3mol H2,充分反应后转移电子的数目为0.6NA |
| D、80g NH4NO3晶体中含有NH4+数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
| B、Al3++SO42-+Ba2++3OH-→Al(OH)3↓+BaSO4↓ |
| C、2Al3++3SO42-+3Ba2++8OH-→2AlO2-+3BaSO4↓+4H2O |
| D、Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、通电使CuC12发生电离 |
| B、a端是直流电源的负极 |
| C、阳极上发生的反应:Cu2++2e-→Cu |
| D、通电一段时间后,在阴极附近观察到黄绿色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①H2SO4 ② |
③NaOH ④ |
⑤Na2SO4 ⑥ |
⑦SO2 ⑧Na2O |
⑨HCl ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com