
| A、H2O、HCOOH、Cu2(OH)2CO3均含有氧元素,都是氧化物 |
| B、HCOOH、H2CO3、H2SO4分子中均含有两个氢原子,都是二元酸 |
| C、HF、CH3CH2OH、NaOH都易溶于水,都是电解质 |
| D、HClO、H2SO4(浓)、HNO3均具有强氧化性,都是氧化性酸 |


科目:高中化学 来源: 题型:
| A、水加热到很高的温度都难以分解 |
| B、水结成冰体积膨胀,密度变小 |
| C、CH4、SiH4、GeH4、SnH4熔点递增 |
| D、乙醇能与水任意比例互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4的摩尔质量是16g |
| B、物质的量是表示含有一定数目粒子集合体的物理量 |
| C、从100mL0.1mol/L盐酸中取出10mL,溶液密度不变 |
| D、4.4gCO2含有0.1mol粒子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
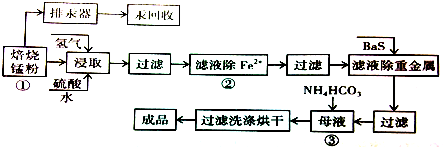

查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol?L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和 (Ⅲ)实验①和 |
| ② | ||||
| ③ | ||||
| ④ |

查看答案和解析>>
科目:高中化学 来源: 题型:
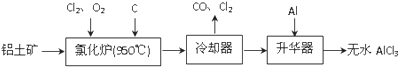
查看答案和解析>>
科目:高中化学 来源: 题型:
 分子筛具有均匀的微孔结构,分子筛筛分作用见图.
分子筛具有均匀的微孔结构,分子筛筛分作用见图.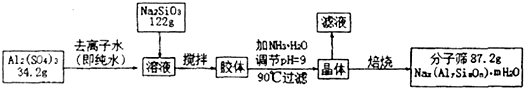
| ? |
| A |
| ? |
| A |
| ? |
| A |
| ? |
| A |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C5H12O3 |
| B、C4H10 |
| C、C6H10O4 |
| D、C5H10O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com