
 在一定温度下,容器内某一反应中 M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某一反应中 M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )| A. | t3时,逆反应速率大于正反应速率 | |
| B. | t2时,正逆反应速率相等,反应达到平衡状态 | |
| C. | t1时,N 的浓度是 M 浓度的 2 倍 | |
| D. | 反应的化学方程式为:2M?N |
分析 根据图象分析,M在反应过程中物质的量增加,为生成物,N在反应过程中物质的量减小,为反应物,根据相同时间内反应过程转化的量之比等于计量数之比,M在t1~t2内转化了1mol,N在t1~t2内转化了2mol,则反应的方程式为:2N?M,据此分析解答.
解答 解:A.根据图象,t3时,反应尚未达到化学平衡,则正反应速率>逆反应速率,故A错误;
B.反应达到平衡状态时,M和N的物质的量均不发生改变,根据图象,t2时,反应尚未达到化学平衡,正反应速率>逆反应速率,故B错误;
C.t1时刻,N的物质的量为6mol,M的物质的量为3mol,在同密闭容器内,物质的量浓度c=$\frac{n}{V}$,则N的浓度是M浓度的2倍,故C正确;
D.M在反应过程中物质的量增加,为生成物,N在反应过程中物质的量减小,为反应物,根据相同时间内反应过程转化的量之比等于计量数之比,M在t1~t2内转化了1mol,N在t1~t2内转化了2mol,则反应的方程式为:2N?M,故D错误.
故选C.
点评 本题考查根据图象分析化学平衡,注意图象是物质的量随时间变化的图,不是正逆反应速率图象,根据相同时间内各组分转化的量之比等于化学计量数之比得出方程式是解题的关键.本题难度不大,是基础题.


科目:高中化学 来源: 题型:选择题
 含氮有机物对乙酰氨基酚(如图)是生活中常见感冒药的主要成分,下列有关对乙酰氨基酚的说法正确的是( )
含氮有机物对乙酰氨基酚(如图)是生活中常见感冒药的主要成分,下列有关对乙酰氨基酚的说法正确的是( )| A. | 对乙酰氨基酚的分子式为:C8H10NO2 | |
| B. | 对乙酰氨基酚可与浓溴水发生加成反应 | |
| C. | 与对乙酰氨基酚互为同分异构体,分子中含有硝基和苯环,且苯环上有三个取代基的分子共有6种 | |
| D. | 对乙酰氨基酚可以与Na2CO3发生反应,产生CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
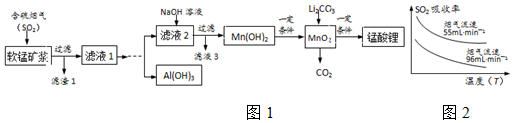
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 25℃时,将0.2mol•L?1 CH3COOH溶液逐滴滴入25mL某浓度的NaOH溶液中,
25℃时,将0.2mol•L?1 CH3COOH溶液逐滴滴入25mL某浓度的NaOH溶液中,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯甲酸易溶于水,可做食品防腐剂 | |
| B. | 提纯苯甲酸的过程中需要用到的玻璃仪器:烧杯、玻璃棒、漏斗 | |
| C. | 粗品中苯甲酸溶解后,还需再加入少量蒸馏水,以减少产品的损失 | |
| D. | 为了获得更多的苯甲酸,此实验中结晶温度越低越好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,所有烷烃都呈气态 | |
| B. | 烷烃在氧气中完全燃烧,$\frac{n(C{O}_{2})}{n({H}_{2}O)}$最小的是甲烷 | |
| C. | 甲烷、乙烷、丙烷的二氯代物分别为2种、3种、4种 | |
| D. | 烷烃中除甲烷外,很多都能使酸性KMnO4溶液的紫色褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2CO3(NH4Cl):加热 | |
| B. | CO2(SO2):饱和碳酸钠溶液、浓硫酸,洗气 | |
| C. | KCl溶液(BaCl2):加入适量K2SO4溶液,过滤. | |
| D. | 蛋白质(葡萄糖):浓Na2SO4溶液,盐析、过滤、洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纤维素和淀粉的组成都可用(C6H10O5)n表示,它们互为同分异构体 | |
| B. | 蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水 | |
| C. | 人造纤维、合成橡胶和光导纤维都属于有机高分子化合物 | |
| D. | 淀粉、油脂、蛋白质都能水解,但水解产物不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ).
).

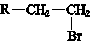
 (R-代表烃基)
(R-代表烃基)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com