

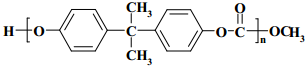
| A. | 分子中含有3种含氧官能团 | |
| B. | 可发生取代、加成、消去、加聚等反应 | |
| C. | 该物质的分子式为C10H10O6 | |
| D. | 1mol分枝酸最多可与3molNaOH发生反应 |
分析 该物质中含有碳碳双键、羧基、醇羟基、醚键,具有烯烃、羧酸、醇、醚的性质,能发生加成反应、加聚反应、取代反应、氧化反应、中和反应、酯化反应等,据此分析解答.
解答 解:A.该物质中含氧官能团是羧基、醇羟基、醚键三种,故A正确;
B.该物质中含有碳碳双键、羧基、醇羟基、醚键,具有烯烃、羧酸、醇、醚的性质,能发生加成反应、加聚反应、取代反应、氧化反应、中和反应、消去反应、酯化反应等,故B正确;
C.根据结构简式确定分子式为C10H10O6,故C正确;
D.1mol分枝酸最多可与2molNaOH发生反应,故D错误;
故选D.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查烯烃、醇、羧酸的性质,题目难度不大.


科目:高中化学 来源: 题型:解答题
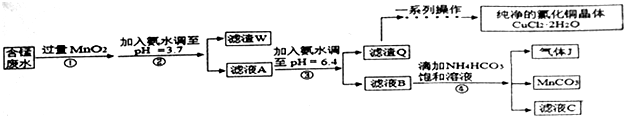
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
| 完全沉淀的pH | 9.7 | 3.7 | 6.4 | 10.4 |
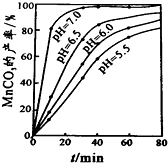
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
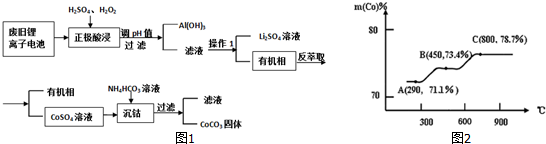
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾净水原理为:Al3++3H2O=Al(OH)3↓+3H+ | |
| B. | 该溶液中AlO2-、F-、K+、Na+能大量共存 | |
| C. | 加入过量NH3•H2O反应的离子方程式为:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| D. | 加入过量Ba(OH)2溶液反应的离子方程式为:Al3++2SO42-+4OH-+2Ba2+=AlO2-十2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
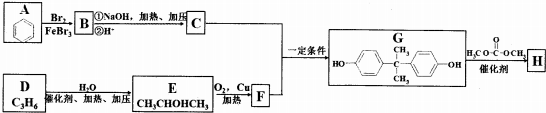
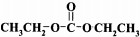 +2ROH$\stackrel{催化剂}{→}$
+2ROH$\stackrel{催化剂}{→}$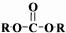 +2CH3CHOH(R为烃基)
+2CH3CHOH(R为烃基)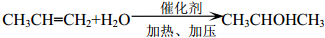 .
.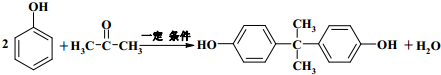 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
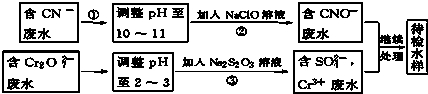
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
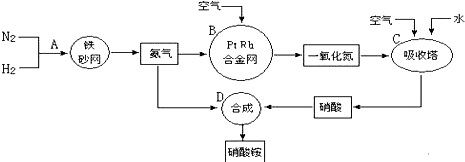
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com