
【题目】在下列物质中选择合适的完成下列各题。
①稀硝酸;②CO;③HF;④熔融NaHSO4;⑤CaO;⑥Cu;⑦蔗糖;⑧Fe2(SO4) 3;⑨酒精;⑩硫酸钡;醋酸;三氧化硫;氯气;醋酸钠
(1) 属于强电解质的是____________________(填序号,下同) 。
(2) 属于弱电解质的是____________________。
(3) 属于非电解质的是_____________________。
(4) 写出③、两种物质在水溶液中的电离方程式:③___________________________;_________________________________。
(5) 醋酸钠溶液显_________性(填酸或碱)的原因:______________________________________________________________ (用离子方程式表示)
【答案】④⑤⑧⑩ ③ ②⑦⑨ HF ![]() H++F- CH3COONa=CH3COO-+Na+ 碱 CH3COO-+H2O
H++F- CH3COONa=CH3COO-+Na+ 碱 CH3COO-+H2O![]() CH3COOH+OH-
CH3COOH+OH-
【解析】
①稀硝酸,硝酸水溶液能自身完全电离出的自由移动的氢离子和硝酸根离子导电;但硝酸溶液是混合物,它既不是电解质也不是非电解质;
②CO是化合物,在水中不溶,没有自由移动的离子,故不能导电;是非电解质;
③HF是纯净物,只有氟化氢分子不导电;氟化氢的水溶液中,氟化氢不能完全电离出氢离子和氯离子,所以是弱电解质;
④熔融NaHSO4,熔融状态下的NaHSO4能完全电离出自由移动的阴阳离子而使其导电,所以NaHSO4是强电解质;
⑤CaO没有自由移动的离子,所以不能导电;CaO在水溶液中与水反应生成氢氧化钙,氢氧化钙电离出自由移动的氢氧根离子和钙离子导电,熔融状态下的CaO能完全电离出自由移动的阴阳离子,CaO是强电解质;
⑥Cu是金属单质,能导电;它是单质,它既不是电解质也不是非电解质;
⑦蔗糖,是化合物,在水中存在蔗糖分子,没有自由移动的离子,故不能导电;是非电解质;
⑧Fe2(SO4) 3没有自由移动的离子不导电;熔融状态下的Fe2(SO4) 3能完全电离出自由移动的阴阳离子而使其导电,所以Fe2(SO4) 3是强电解质;
⑨酒精,是化合物,在水中存在乙醇分子,没有自由移动的离子,故不能导电;是非电解质;
⑩硫酸钡,没有自由移动的离子不导电;在水溶液中虽难溶,但溶于水的部分或熔化状态下都能完全电离,BaSO4═Ba2++SO42-有自由移动的离子,能导电,是强电解质;
醋酸,只存在分子,没有自由移动的离子不导电;CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+能导电,是弱电解质,CH3COOH
CH3COO-+H+能导电,是弱电解质,CH3COOH![]() CH3COO-+OH-,在水溶液中不能完全电离,能导电,CH3COOH为弱电解质;
CH3COO-+OH-,在水溶液中不能完全电离,能导电,CH3COOH为弱电解质;
三氧化硫,SO3只存在分子,没有自由移动的离子,所以不能导电;三氧化硫在水溶液中与水反应生成硫酸,硫酸电离出自由移动的氢离子和硫酸根离子导电,三氧化硫自身不能电离,三氧化硫是非电解质;
氯气只存在Cl2分子,不能导电;它是单质,它既不是电解质也不是非电解质;
醋酸钠没有自由移动的离子不导电;熔融状态下的醋酸钠能完全电离出自由移动的阴阳离子而使其导电,所以醋酸钠是强电解质;
(1) 属于强电解质的是④⑤⑧⑩。
(2) 属于弱电解质的是③。
(3) 属于非电解质的是②⑦⑨。
(4) 写出③、两种物质在水溶液中的电离方程式:③氟化氢是弱电解质,不能全部电离 HF ![]() H++F-;CH3COONa是强电解质,全部电离CH3COONa=CH3COO-+Na+ 。
H++F-;CH3COONa是强电解质,全部电离CH3COONa=CH3COO-+Na+ 。
(5) 醋酸钠在水中水解,溶液显碱性(填酸或碱)的原因:CH3COO-+H2O![]() CH3COOH+OH-。
CH3COOH+OH-。


科目:高中化学 来源: 题型:
【题目】现有![]() 、
、![]() 两种溶液,选择填空:
两种溶液,选择填空:
A. ![]()
(1)当它们pH相同时,其物质的量浓度______.
(2)当它们的物质的量浓度相同时,其pH的关系是______.
(3)中和等体积、等物质的量浓度的烧碱溶液,需同物质的量浓度的两种酸溶液的体积关系为______.
(4)体积和物质的量浓度相同的![]() 、
、![]() 两溶液,分别与同浓度的烧碱溶液反应,要使反应后的溶液呈中性,所需烧碱溶液的体积关系为______.
两溶液,分别与同浓度的烧碱溶液反应,要使反应后的溶液呈中性,所需烧碱溶液的体积关系为______.
(5)当它们pH相同、体积相同时,分别加入足量锌,相同状况下产生气体体积关系为______.
(6)将pH相同的两种酸均稀释10倍后,pH关系为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在298 K条件下,2mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是( )。
A.2H2(g) + O2(g) = 2H2O(1) △H = - 484 kJ·mol-1
B.H2O(g) = H2(g) + ![]() O2(g) △H = + 242 kJ·mol-1
O2(g) △H = + 242 kJ·mol-1
C.H2(g) + ![]() O2(g) = H2O(g) △H = + 242 kJ·mol-1
O2(g) = H2O(g) △H = + 242 kJ·mol-1
D.2H2(g) + O2(g) = 2H2O(g) △H = + 484 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前中药在世界医学界越来越受到关注。中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病。工业上利用酸性高浓度含砷废水(砷主要以亚砷酸H3AsO3形式存在)提取As2O3的工艺流程如下:
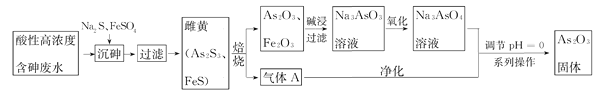
已知:As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)![]() 2AsS32-
2AsS32-
回答下列问题:
(1)H3AsO3是一种两性偏酸性的化合物,As元素的化合价为_____________。
(2)“沉砷”中FeSO4的作用是________________________。
(3)“焙烧”过程产生的气体A的化学式为____________,检验该气体常用试剂为___________。
(4)调节pH=0时,发现酸性越强,As2O3的产率越高。可能的原因是__________________。获得As2O3固体,系列操作是________、______、_______。
(5)残留废渣中少量砒霜(As2O3)可以用双氧水氧化成H3AsO4而除去,该反应的化学方程式为:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的四种短周期主族元素,A、B、C、D、E为上述四种元素中的两种元素组成的化合物,Z2为Z元素的一种单质。已知:A、D均含有10个电子,C的相对分子质量为30。上述物质之间的转化关系如图所示(部分反应物或生成物省略),则下列说法中不正确的是
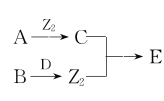
A.原子半径:W>Y>Z>X
B.若C中混有E可用水洗方法除去
C.A在工业上常用作制冷剂
D.B与D反应生成Z2时,D作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下在一容积恒为2L的容器内发生反应:2A(g)+B(g)![]() 2C(g),已知起始投入4molA(g)和2molB(g),经2s后测得C的浓度为0.6mol/L,并且2s后各组分浓度不再改变。下列说正确的是( )
2C(g),已知起始投入4molA(g)和2molB(g),经2s后测得C的浓度为0.6mol/L,并且2s后各组分浓度不再改变。下列说正确的是( )
A.2s内用物质A表示的平均反应速率为0.6mol/(L·s)
B.该条件下,该反应的平衡常数为K=![]()
C.2s后每有0.6mol的物质B生成,同时就有0.6mol物质C生成
D.2s时物质B的浓度为0.7mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3OH是重要的化工原料,工业上用CO与H2在催化剂作用下合成CH3OH,其反应为:CO(g)+2H2(g)CH3OH(g)。按n(CO):n(H2)=1:2,向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法中,正确的是
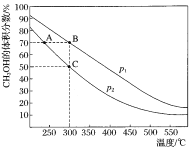
A. p1<p2
B. 该反应的ΔH>0
C. 平衡常数:K(A)=K(B)
D. 在C点时,CO转化率为75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硫酸的反应原理主要有下列三个反应:
①FeS2(s)+O2(g)![]() Fe2O3(s)+SO2(g);ΔH1
Fe2O3(s)+SO2(g);ΔH1
②2SO2(g)+O2(g)![]() 2SO3(g); ΔH2
2SO3(g); ΔH2
③SO3+H2O=H2SO4
Ⅰ.(1)反应①配平后各物质系数分别为_____、______、_______、______。若每生成1molSO2时反应放热426.5kJ,则ΔH1=_______________。
(2)工业生产中将FeS2矿石粉碎后投入反应器中反应,这样做的目的是___________。
Ⅱ.下表是不同温度和压强下反应②中SO2的转化率
0.1Mp | 0.5Mp | 1Mp | 10Mp | |
400℃ | 99.2 | 99.6 | 99.7 | 99.9 |
500℃ | 93.5 | 96.9 | 97.8 | 99.3 |
600℃ | 73.7 | 85.8 | 89.5 | 96.4 |
(3)反应②是气体体积缩小的可逆反应,增大压强有利于提高原料转化率,但工业生产中该反应在常压下进行,采用常压生产条件的理由是_______________________。
(4)若原料气组成:SO2 7%,O211%,N2 82%,在温度和压强不变的条件下,混合气体体积变为原来的97.2%,则SO2的转化率为_________。
Ⅲ.尾气中的二氧化硫对环境造成污染,需要处理后才能排放。常用亚硫酸钠吸收法。
(5)Na2SO3溶液吸收SO2的离子方程式为________________________ ;
(6)常温下,当吸收至pH=6时,吸收液中相关离子浓度关系一定正确的是____(填序号)
A.c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-)
B.c(Na+)=c(SO32-)+c(HSO3-)+C(H2SO3)
C.c(Na+)>c(SO32-)>c(OH-)>c(H+)
D.水电离出c(OH-)=l×l0-8 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com