
已知次氯酸是比碳酸还弱的酸,反应Cl2+H2O??HCl+HClO达到平衡后,要使HClO浓度增大,可加入( )
A.NaCl固体 B.水
C.CaCO3固体 D.NaOH固体
 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:
铁及其化合物在日常生活中很常见
(1)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:
 |
回答下列问题:
①操作II所包含的两项主要基本操作是 。 上述流程中,Fe(OH)2转化成Fe(OH)3时的化学方程式为 。
②将FeCl2溶液高温水解、氧化也可直接制得氧化铁,请写出反应的化学方程式: 。
(2)有些同学认为用KMnO4溶液能进行绿矾(FeSO4·7H2O)产品中铁元素含量的测定,反应的离子方程式为: ,该滴定过程中 (填“是”或“否”)还需要指示剂。
实验步骤如下:
a. 考虑绿矾产品可能因为保存不当被空气中氧气所氧化,所以事先取少量绿矾产品溶于水,滴加 溶液进行验证。
b.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;
c. 量取25.00mL待测溶液于锥形瓶中;
d. 用硫酸酸化的0.01000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
请完成下列问题:
① 实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需 。
② 某同学设计的下列滴定方式,最合理的是________。(夹持部分略去)(填字母序号)

③计算上述样品中FeSO4·7H2O的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
稀氨水中存在着下列平衡:NH3·H2O??NH +OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )
+OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )
①NH4Cl固体 ②硫酸 ③NaOH固体 ④水 ⑤加热 ⑥加入少量MgSO4固体
A.①②③⑤ B.③⑥
C.③ D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,甲、乙两烧杯均盛有5 mL pH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4。关于甲、乙两烧杯中溶液的描述正确的是( )
A.溶液的体积10V甲≤V乙
B.水电离出的OH-浓度:10c(OH-)甲≤c(OH-)乙
C.若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙
D.若分别与5 mL pH=11的NaOH溶液反应,所得溶液的pH :甲≤乙
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于电解质的叙述正确的是( )
A.电解质溶液的浓度越大,其导电性能一定越强
B.强酸和强碱一定是强电解质,不管其水溶液浓度的大小,都能完全电离
C.强极性共价化合物不一定都是强电解质
D.多元酸、多元碱的导电性一定比一元酸、一元碱的导电性强
查看答案和解析>>
科目:高中化学 来源: 题型:
在基态多电子原子中,关于核外电子能量的叙述错误的是( )
A.电离能最小的电子能量最高
B.在离核最近区域内运动的电子能量最低
C.最易失去的电子能量最高
D.p轨道电子能量一定高于s轨道电子能量
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为长式周期表的一部分,其中的编号代表对应的元素。
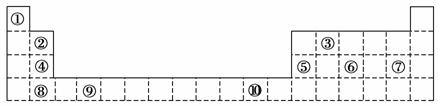
请回答下列问题:
(1)表中属于d区元素的是________(填元素符号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为________;③和⑦形成的一种常见溶剂的化学式为________,其立体构型为________。
(3)某元素原子的外围电子排布式为nsnnpn+1,该元素原子的最外电子层上孤电子对数为________;该元素与元素①形成的最简单分子X属于________分子(填“极性”或“非极性”)。
(4)元素④的第一电离能________元素⑤(选填“>”、“=”或“<”)的第一电离能;元素⑥的电负性________元素⑦(选填“>”、“=”或“<”)的电负性。
(5)元素⑦和⑧形成的化合物的电子式为________。
(6)元素⑩的基态原子核外电子排布式是________。
(7)某些不同族元素的性质也有一定的相似性,如上表中元素②与元素⑤的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:__________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
为达到预期的实验目的,下列操作正确的是( )
①配制FeCl3溶液时,将FeCl3固体溶于盐酸中,然后再用水稀释到所需的浓度 ②用10 mL的量筒量取4.80 mL的浓硫酸 ③蒸发溶液时,边加热边搅拌,直至蒸发皿中的液体蒸干 ④向无色溶液中加入BaCl2溶液,生成白色沉淀,再加稀硝酸,沉淀不消失,由此确定该溶液中一定含有SO ⑤为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量 ⑥中和热测定的实验中使用的玻璃仪器只有2种 ⑦实验室可利用浓氨水和碱石灰混合的方法制取少量氨气 ⑧除去NO中混有的NO2气体可通过水洗,再干燥后用向上排空气法收集
⑤为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量 ⑥中和热测定的实验中使用的玻璃仪器只有2种 ⑦实验室可利用浓氨水和碱石灰混合的方法制取少量氨气 ⑧除去NO中混有的NO2气体可通过水洗,再干燥后用向上排空气法收集
A.③⑤⑧ B.④⑤⑥
C.①⑤⑦ D.①⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
下列组合判断正确的是( )
①Cl2具有很强的氧化性,在化学反应中只能作氧化剂(2009·山东理综,10A)
②浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应(2009·山东理综,13C改编)
③化合反应均为氧化还原反应(2012·山东理综,7A)
④Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性(2012·山东理综,12A)
⑤Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应(2012·山东理综,12C)
A.①②不正确,③④⑤正确
B.①②③④正确,⑤不正确
C.①②正确,③④⑤不正确
D.①②③④⑤均不正确
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com