
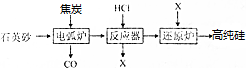
分析 (1)石英砂主要成分为二氧化硅,二氧化硅和碳在高温的条件下反应生成碳化硅和一氧化碳,焦炭中的碳的化合价升高是还原剂;
(2)其中主产物的氯元素的质量百分含量为78.6%,是SiHCl3,粗硅与干燥HCl气体反应制得SiHCl3(常温下为液态,易挥发);生成1molX转移电子的物质的量为:2mol;
(3)流程中可供循环使用的物质有氢气和氯化氢,电解饱和食盐水制得,工业上叫氯碱工业;
(4)普通玻璃以石英砂和 纯碱和石灰石等为原料制得.
解答 解:(1)石英砂主要成分为二氧化硅,二氧化硅和碳在高温的条件下反应生成碳化硅和一氧化碳,焦炭中的碳的化合价升高是还原剂,故答案为:还原剂;
(2)粗硅与干燥HCl气体反应Si+3HCl$\frac{\underline{\;高温\;}}{\;}$SiHCl3+H2,每生成 0.5molX,转移的电子物质的量0.5×2=1mol,故答案为:Si+3HCl$\frac{\underline{\;高温\;}}{\;}$SiHCl3+H2;1;
(3)流程中可供循环使用的物质有氢气和氯化氢,电解饱和食盐水制得,工业上叫氯碱工业,故答案为:H2、HCl;氯碱工业;
(4)普通玻璃以石英砂和纯碱和石灰石等为原料制得,故答案为:纯碱;石灰石.
点评 本题考查了实验方案设计的有关知识,侧重考查了硅及其化合物的有关知识,注意粗硅的提纯反应原理,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | A=B | B. | A<B | C. | 无法判断 | D. | A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁粉与稀盐酸的反应:Fe+2H+═Fe2++H2↑ | |
| B. | 硫酸铝溶液与氨水的反应:Al3++3OH-═Al(OH)3↓ | |
| C. | 氢氧化铜与稀硫酸的反应:OH-+H+═H2O | |
| D. | 钠与水的反应:Na+2H2O═Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
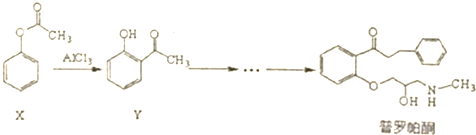
| A. | 普罗帕酮分子中有2个手性碳原子 | |
| B. | 可用溴水或FeCI3溶液鉴别X和Y | |
| C. | 反应物X与中间体Y互为同分异构体 | |
| D. | 普罗帕酮能发生加成、氧化、消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
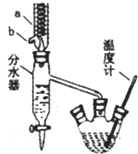 苯甲酸具有弱酸性,可以和乙醇发生酯化反应生成苯甲酸乙酯.苯甲酸乙脂 (密度1.05g ?cm-3)稍有水果气味,用于配制香水香精和人造精油,也大量用于食品以及用作有机合成中间体等.制备苯甲酸乙脂的过程如下:
苯甲酸具有弱酸性,可以和乙醇发生酯化反应生成苯甲酸乙酯.苯甲酸乙脂 (密度1.05g ?cm-3)稍有水果气味,用于配制香水香精和人造精油,也大量用于食品以及用作有机合成中间体等.制备苯甲酸乙脂的过程如下:| 沸点(℃,1atm) | ||||||
| 苯甲酸 | 苯甲酸乙酯 | 石油醚 | 水 | 乙醇 | 环己烷 | 共沸物(环已烷-水-乙醇) |
| 249 | 212.6 | 40-80 | 100 | 78.3 | 80.75 | 62.6 |
 +CH3CH2OH$?_{△}^{浓硫酸}$
+CH3CH2OH$?_{△}^{浓硫酸}$ +H2O仪器a的名称冷凝管,b口的作用为出水口,
+H2O仪器a的名称冷凝管,b口的作用为出水口,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com