
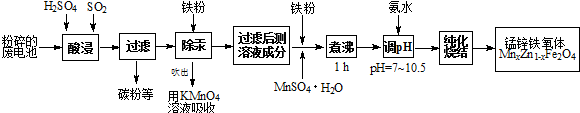
分析 以含锰废旧碱性锌锰电池为原料制备锰锌铁氧体,二氧化硫能与二氧化锰反应生成硫酸锰,过滤除去不溶性杂质碳粉等,滤液中加入铁粉,铁粉具有还原性,能把汞离子还原为汞单质,除去汞,吹出的汞用高锰酸钾溶液吸收,除汞后的溶液加入铁粉、硫酸锰煮沸,纯化烧结得到锰锌铁氧体.
(1)锌锰电池酸浸废电池时,被溶解生成Zn2+的物质有Zn、Zn(OH)2,SO2的作用是还原剂;
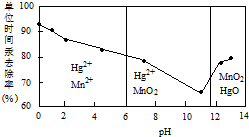
(2)①由图可知,pH<6时Hg与酸性高锰酸钾反应生成Hg2+、Mn2+;
②由图可知,随pH值的升高汞的去除率先降低后增加;
(3)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(4)Mn为+2价、Zn为+2价,利用化合价代数和为0,计算Fe元素化合价,再结合Mg、Zn、Fe原子数目之比改写为氧化物形式;结合锰原子守恒可知,补充硫酸锰晶体锰的物质的量等于锰锌铁氧体晶体中锰的物质的量与原废旧碱性锌锰电池中锰元素的物质的量之和,进而计算需补充硫酸锰晶体质量.
解答 解:(1)碱性锌锰干电池工作原理为:Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH,酸浸废电池时,锌被溶解生成Zn2+,Zn(OH)2被溶解生成Zn2+,二氧化硫能与二氧化锰反应生成硫酸锰,SO2的作用是还原剂,
故答案为:Zn、Zn(OH)2;D;
(2)①由图可知,pH<6时Hg与酸性高锰酸钾反应生成Hg2+、Mn2+,反应离子方程式为:5Hg+2MnO4-+16H+=5Hg2++2Mn2++8H2O,
故答案为:5Hg+2MnO4-+16H+=5Hg2++2Mn2++8H2O;
②由图象可知,汞的吸收率随着PH的增大先减小后增大,
故答案为:随pH增大,汞的去除速率先减小后增大;
(3)2MnO(s)+O2(g)═2MnO2(s)△H=-272.0kJ/mol①
MnCO3(s)═MnO(s)+CO2(g)△H=+116.6kJ/mol②
将①+②×2可得:2MnCO3(S)+O2(g)═2MnO2(S)+2CO2(g)△H=[-272.0+2×(+116.6)]kJ/mol=-38.8 kJ/mol;
故答案为:2MnCO3(s)+O2(g)═2MnO2(s)+2CO2(g)△H=-38.8 kJ/mol;
(4)Mn为+2价、Zn为+2价,当x=0.2时,利用化合价代数和为0,可知Fe元素化合价为+3,改写为氧化物形式为:MnO•4ZnO•5Fe2O3,若制得这种锰锌铁氧体的质量为100kg,则锰的物质的量为$\frac{100×0.2}{239}$mol,a kg废旧碱性锌锰电池为原料(含锰元素的物质:MnO2占b%,MnOOH占c%),所含的锰的物质的量为$\frac{a×b%}{87}+\frac{a×c%}{88}$mol,所以需补充硫酸锰晶体质量169×($\frac{20}{239}$-$\frac{ab%}{87}$-$\frac{ac%}{88}$),
故答案为:MnO•4ZnO•5Fe2O3;169×($\frac{20}{239}$-$\frac{ab%}{87}$-$\frac{ac%}{88}$).
点评 本题考查锰锌铁氧体制备工艺,侧重考查物质的分离提纯、对操作的分析评价、读图获取信息能力等,侧重考查学生对知识的迁移运用,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 单质的沸点:Z>X>Y | |
| B. | 单质的氧化性:W<Z<Y<X | |
| C. | 气态氢化物的稳定性:W>X>Y>Z | |
| D. | W单质可以将X从其盐溶液中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH在水中电离:CH3COOH═H++CH3COO- | |
| B. | 乙醇氧化成乙醛的化学方程式:2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| C. | 乙酸与乙醇发生酯化反应:CH3COOH+CH3CH2OH$→_{△}^{催化剂}$CH3COOCH2CH3 | |
| D. | CaCO3高温分解的热化学方程式:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,△H=+178.5 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
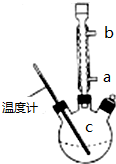
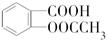 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下: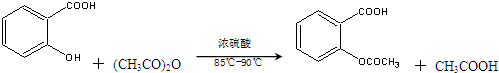
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 易水解 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 难溶电解质的Ksp越小,溶解度就一定越小 | |
| B. | 向含AgCl沉淀的悬浊液中加入NaCl饱和溶液,AgCl的溶解度变小,溶度积常数变小 | |
| C. | 用饱和Na2CO3溶液可以将BaSO4转化为BaCO3,说明Ksp(BaCO3)小于Ksp(BaSO4) | |
| D. | 一般认为沉淀离子浓度小于1.0×10-5 mol/L时,离子就已沉淀完全 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
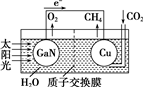 科学家用氮化镓材料与铜组装成如图的人工光合系统,实现了以CO2和H2O为原料合成CH4.下列有关说法中正确的是( )
科学家用氮化镓材料与铜组装成如图的人工光合系统,实现了以CO2和H2O为原料合成CH4.下列有关说法中正确的是( )| A. | 该装置是将化学能转化为电能 | |
| B. | 氮化镓电极是阳极 | |
| C. | 铜电极表面的电极反应式为CO2+8e-+8H+═CH4+2H2O | |
| D. | 可用盐酸作该装置的电解液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
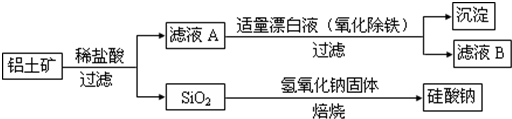
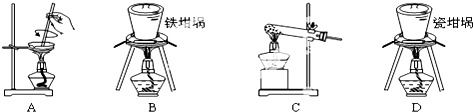
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com