
 $��_{H_{2}O}^{HCl}$
$��_{H_{2}O}^{HCl}$
 $��_{��Zn/H_{2}O}^{��O_{3}}$
$��_{��Zn/H_{2}O}^{��O_{3}}$
 ��
�� ���÷�Ӧ����������Ӧ
���÷�Ӧ����������Ӧ
���� �л���A��C��H��O����Ԫ����ɣ�Mr��A��=$\frac{12}{0.1}$=120��0.1molA�������������г��ȼ�պ�����0.8molCO2��7.2g H2O��ˮ�����ʵ���=$\frac{7.2g}{18g/mol}$=0.4mol������ԭ���غ��֪�����л�����N��C��=$\frac{0.8mol}{0.1mol}$=8��N��H��=$\frac{0.4mol��2}{0.1mol}$=8�����л�����N��O��=$\frac{120-12��8-8}{16}$=1�����л���A�ķ���ʽΪC8H8O��Aϵ�з�Ӧ�õ�����ȩE�������Ϣ��ȩ��HCN�ļӳɷ�Ӧ����֪A����C=O˫����A��HCN�����ӳɷ�Ӧ����B��B����ˮ�ⷴӦ����C��C��Ũ���ᡢ��������������D��D��ʹ������Ȼ�̼��Һ��ɫ��ӦΪ������ȥ��Ӧ��D��������������E��F��F��������������G��G����Է�������Ϊ90����GΪHOOC-COOH����FΪOHC-COOH��EΪ ��DΪ
��DΪ ��CΪ
��CΪ ��BΪ
��BΪ ��A�Ľṹ��ʽΪ
��A�Ľṹ��ʽΪ ���ݴ˽��н��
���ݴ˽��н��
��� �⣺�л���A��C��H��O����Ԫ����ɣ�Mr��A��=$\frac{12}{0.1}$=120��0.1molA�������������г��ȼ�պ�����0.8molCO2��7.2g H2O��ˮ�����ʵ���=$\frac{7.2g}{18g/mol}$=0.4mol������ԭ���غ��֪�����л�����N��C��=$\frac{0.8mol}{0.1mol}$=8��N��H��=$\frac{0.4mol��2}{0.1mol}$=8�����л�����N��O��=$\frac{120-12��8-8}{16}$=1�����л���A�ķ���ʽΪC8H8O��Aϵ�з�Ӧ�õ�����ȩE�������Ϣ��ȩ��HCN�ļӳɷ�Ӧ����֪A����C=O˫����A��HCN�����ӳɷ�Ӧ����B��B����ˮ�ⷴӦ����C��C��Ũ���ᡢ��������������D��D��ʹ������Ȼ�̼��Һ��ɫ��ӦΪ������ȥ��Ӧ��D��������������E��F��F��������������G��G����Է�������Ϊ90����GΪHOOC-COOH����FΪOHC-COOH��EΪ ��DΪ
��DΪ ��CΪ
��CΪ ��BΪ
��BΪ ��A�Ľṹ��ʽΪ
��A�Ľṹ��ʽΪ ��
��
��1��ͨ�����Ϸ���֪��A�Ľṹ��ʽΪ�� ��
��
�ʴ�Ϊ�� ��
��
��2�������ǻ����Ȼ����ܷ���������Ӧ������A��G���ܹ�������ȥ��Ӧ���л����У�B��C��D��F��G��
�ʴ�Ϊ��B��C��D��F��G��
��3��C��Ũ������ȵ�������ʱ����������ˮ������D�����������һ���л���÷�Ӧ�Ļ�ѧ����ʽΪ�� ���÷�Ӧ������������Ӧ��
���÷�Ӧ������������Ӧ��
�ʴ�Ϊ�� ��������Ӧ��
��������Ӧ��
��4��C�� ����ͬ���칹���ж��֣����з�������Ҫ����л����ж��֣�
����ͬ���칹���ж��֣����з�������Ҫ����л����ж��֣�
������3mol NaOH��Һ��Ӧ�����з��ǻ�����������γɵ�������
�ڱ����ϵ�һ±����ֻ��һ�֣������Ϻ���1����ԭ�ӣ�
���ܷ���������Ӧ����Ϣٿ�֪������Ϊ��������γɵ�������
�����������л���Ľṹ��ʽΪ�� ��
��
�ʴ�Ϊ�� ��
��
��5��C�� ����4-��-2��3-�����������֮��1��1����ȡ����Ӧ��������C�е��Ȼ���4-��-2��3-������е������ǻ��ֱ�Ӧ���������ʣ�Ҳ������C�е��ǻ���4-��-2��3-������е��ǻ����ѵķ�ӦҲ���Ե����ֽṹ��Ҳ������C�е��Ȼ����ǻ�ͬʱ��4-��-2��3-������е������Ƿ�Ӧ��Ҳ���Ե����ֽṹ�����Թ���6�������
����4-��-2��3-�����������֮��1��1����ȡ����Ӧ��������C�е��Ȼ���4-��-2��3-������е������ǻ��ֱ�Ӧ���������ʣ�Ҳ������C�е��ǻ���4-��-2��3-������е��ǻ����ѵķ�ӦҲ���Ե����ֽṹ��Ҳ������C�е��Ȼ����ǻ�ͬʱ��4-��-2��3-������е������Ƿ�Ӧ��Ҳ���Ե����ֽṹ�����Թ���6�������
�ʴ�Ϊ��6��
���� ���⿼���л����ƶϣ�Ϊ�߿��ȵ����ͣ���Ŀ�ѶȽϴ��Ƕ��л�������֪ʶ���ۺϿ��飬�ܽϺõĿ��鿼������ѧ������������Ϣ�и���ķ�Ӧ�ǽ���Ĺؼ�����Ҫѧ���������չ����ŵ�������ת����


 Ӯ�ڿ�����ʦ��ʱ�ƻ�ϵ�д�
Ӯ�ڿ�����ʦ��ʱ�ƻ�ϵ�д� �������Ͽ�ʱͬ��ѵ��ϵ�д�
�������Ͽ�ʱͬ��ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������������Ԫ�����ȵĵ�һ��������� | |
| B�� | �ĵ縺�Ա���ĵ縺�Դ� | |
| C�� | ��Ȼ������Ԫ���У����ĵ�һ���������蘆ĵ�һ��������С | |
| D�� | ����������Ԫ����ĵ�һ�����ܱ�Ԫ�����ĵ�һ������С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��߷�Ӧ��������� | B�� | �ı�ƽ���������� | ||
| C�� | ��ͬ���̶ȸı����淴Ӧ������ | D�� | ��������Ӧ���ʣ���С�淴Ӧ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
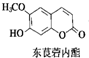 �в�ҩ�г����ڶ�ݹ�������������㶹��������ݹ�������ṹ��ͼ��ʾ�����ж�ݹ��������˵����ȷ���ǣ�������
�в�ҩ�г����ڶ�ݹ�������������㶹��������ݹ�������ṹ��ͼ��ʾ�����ж�ݹ��������˵����ȷ���ǣ�������| A�� | ����ʽΪC10H12O4 | |
| B�� | ����FeCl3��Һ������ɫ��Ӧ | |
| C�� | һ�������£�1 mol������������3 mol Br2��Ӧ | |
| D�� | һ�������£�1 mol������������1 mol NaOH��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
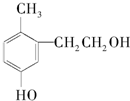
| A�� | �������ڼ��������¿�����ͭ��Ӧ����һ�־���ȩ���Ļ����� | |
| B�� | 1 mol������������ˮ��Ӧ����3 mol Br2����ȡ����Ӧ | |
| C�� | 1 mol���л����������������Ʒ�Ӧ����0.5 mol H2 | |
| D�� | 1 mol���л�������2 mol NaOH��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| Ԫ�ر�� | Ԫ�����ʻ�ԭ�ӽṹ |
| T | ��������ˮ���ҷ�Ӧ��������Һ�������� |
| X | K��������L���������4�� |
| Y | ��������Ԫ�صļ������а뾶��С |
| Z | L��������δ�ɶԵ��� |
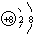 ��д��Ԫ��Z����̬�⻯��ĵ���ʽ
��д��Ԫ��Z����̬�⻯��ĵ���ʽ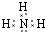 ����Ԫ�ط��ű�ʾ��
����Ԫ�ط��ű�ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ͨ��״�����ǹ��� | B�� | ������-3��+3��+5�ȶ��ֻ��ϼ� | ||
| C�� | As2O5��Ӧˮ��������Ա�H3PO4�� | D�� | ��Ļ�ԭ�Ա����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
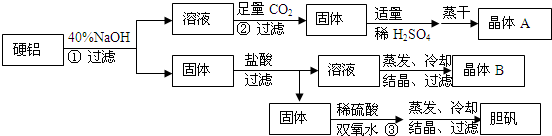
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com