
 HSO3-+OH-,所以滴入酚酞后溶液变红,在该溶液中加入BaCl2后,Ba2++SO32-=BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去.
HSO3-+OH-,所以滴入酚酞后溶液变红,在该溶液中加入BaCl2后,Ba2++SO32-=BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去.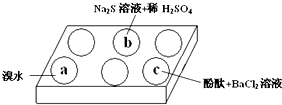
分析 (1)实验探究题,通过观察实验现象进行答题,溴水显棕红色,具有氧化性,Na2SO3 硫元素+4价,表现出一定的还原性,溴水与亚硫酸钠可发生氧化还原反应;
(2)在酸性环境下Na2S与Na2SO3反应,因+4价的S和-2价的S可以发生化合价规中反应,根据氧化还原反应中化合价规中定律的进行作答;
(3)亚硫酸钠是强碱弱酸盐,弱酸根离子在溶液中存在水解,水解后溶液显碱性,酚酞遇碱变色,再加入氯化钡溶液,钡离子与亚硫酸根离子生成亚硫酸钡沉淀,使亚硫酸根的水解逆向进行,氢氧根离子浓度减小,进行作答.
解答 解:(1)a中滴加溴水,观察到溴水为棕红色,再滴加亚硫酸钠,溴水褪色,反应离子方程式为:SO32-+Br2+H2O=2Br-+SO42-+2H+,亚硫酸根中S化合价升高,被氧化,表现还原性,
故答案:溴水褪色;还原;
(2)酸性条件下,+4价的S和-2价的S反应,生成0价的S,故有淡黄色沉淀,发生的离子反应为SO32-+2S2-+6H+=3S↓+3H2O,
故答案为:SO32-+2S2-+6H+=3S↓+3H2O;
(3)酚酞作为酸碱指示剂,遇碱变红,在Na2SO3溶液中,SO32-水解显碱性:SO32-+H2O HSO3-+OH-,所以滴入酚酞后溶液变红;在该溶液中加入BaCl2后,Ba2++SO32-=BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去,
HSO3-+OH-,所以滴入酚酞后溶液变红;在该溶液中加入BaCl2后,Ba2++SO32-=BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去,
故答案为:在Na2SO3溶液中,SO32-水解显碱性:SO32-+H2O HSO3-+OH-,所以滴入酚酞后溶液变红,在该溶液中加入BaCl2后,Ba2++SO32-=BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去.
HSO3-+OH-,所以滴入酚酞后溶液变红,在该溶液中加入BaCl2后,Ba2++SO32-=BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去.
点评 本题为实验探究题,考查常见的氧化还原反应,盐的水解,影响水解的因素.难度中等.


科目:高中化学 来源: 题型:填空题
 铁及其化合物在生产生活及科学研究方面应用非常广泛.
铁及其化合物在生产生活及科学研究方面应用非常广泛. ,其空间构型为直线型;
,其空间构型为直线型;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯与环丁烷互为同系物 | |
| B. | 碳氢化合物中的化学键都是极性键 | |
| C. | 乙醇与金属钠反应时,乙醇分子中的C-H键断裂 | |
| D. | 苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 加入盐酸积V/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 测得溶液温度/℃ | 15.2 | 19.6 | 22.0 | 26.0 | 28.2 | 26.7 | 25.7 | 24.7 | 23.7 | 22.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Al+2OH-+2H2O=2AlO2-+3H2↑ | |
| B. | 2HCO3-+2AlO2-+H2O=2CO2↑+2Al(OH)3↓ | |
| C. | NH4++AlO2-+2H2O=NH3•H2O+Al(OH)3↓ | |
| D. | 3H++Al(OH)3=Al3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,7.8g固体Na2O2中,含有的阴阳离子总数为0.3NA | |
| B. | 4.48L氨气分子中含有0.6NA个N-H键 | |
| C. | 铁、Cu片、稀硫酸组成原电池,当金属铁质量减轻5.6g时,流过外电路的电子为0.3NA | |
| D. | 4℃时,18g2H216O中含有共用电子对数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲乙装置连接是a接c、b接d | |
| B. | 甲装置工作时H+ 移向负极 | |
| C. | 乙装置阴极室溶液的pH与电解前相比将升高 | |
| D. | a和c电极都发生CO(NH2)2-6e-+H2O═N2↑+CO2↑+6H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com