
ЁОЬтФПЁПвбжЊAЮЊЕЛЦЩЋЙЬЬхЃЌTЁЂRЮЊСНжжГЃМћЕФгУЭОКмЙуЕФН№ЪєЕЅжЪЃЌDЪЧОпгаДХадЕФКкЩЋОЇЬхЃЌCЪЧЮоЩЋЮоЮЖЕФЦјЬхЃЌHЪЧАзЩЋГСЕэЃЌЧвдкГБЪЊПеЦјжабИЫйБфЮЊЛвТЬЩЋЃЌзюжеБфЮЊКьКжЩЋЙЬЬхЁЃ
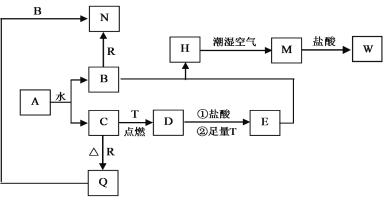
ЃЈ1ЃЉаДГіЯТСаЮяжЪЕФЛЏбЇЪНЃКAЃК_______ЃЌDЃК_________ЃЌRЃК____________ЁЃ
ЃЈ2ЃЉАДвЊЧѓаДЯТСаЗДгІЗНГЬЪНЃК
HдкГБЪЊПеЦјжаБфГЩMЕФЙ§ГЬжаЕФЛЏбЇЗНГЬЪН____________________ЃЛ
BКЭRЗДгІЩњГЩNЕФРызгЗНГЬЪН________________________________ЃЛ
DгыбЮЫсЗДгІЕФРызгЗНГЬЪН_____________________________________ЁЃ
ЃЈ3ЃЉМьбщЦјЬхCЕФЗНЗЈ_________________________________________ЁЃ
ЁОД№АИЁПNa2O2 Fe3O4 Al 4Fe(OH)2+O2+2H2OЃН4Fe(OH)3 2Al+2OHЃ+2H2OЃН2AlO2Ѓ+3H2Ёќ Fe3O4+8H+ЃНFe2++2Fe3++4H2O гУДјЛ№аЧЕФФОЬѕЩьШыЪдЙмПкЃЌШєДјЛ№аЧЕФФОЬѕИДШМЃЌЫЕУїгабѕЦјЩњГЩ
ЁОНтЮіЁП
ЪдЬтAЮЊЕЛЦЩЋЙЬЬхЃЌЧвФмКЭЫЎЗДгІЃЌдђAЮЊNa2O2ЃЌAКЭЫЎЗДгІЩњГЩNaOHКЭO2ЃЌCЪЧЮоЩЋЮоЮЖЕФЦјЬхЃЌдђCЪЧO2ЁЂBЪЧNaOHЃЛDЪЧОпгаДХадЕФКкЩЋОЇЬхЃЌдђDЪЧFe3O4ЃЌFeдкбѕЦјжаШМЩеЩњГЩЫФбѕЛЏШ§ЬњЃЌдђTЪЧFeЃЌRКЭбѕЦјЗДгІЩњГЩбѕЛЏЮяQЃЌQФмКЭNaOHШмвКЗДгІЃЌдђQЪЧAl2O3ЁЂRЪЧAlЃЌNЪЧNaAlO2ЃЌHЪЧАзЩЋГСЕэЃЌЧвдкГБЪЊПеЦјжабИЫйБфЮЊЛвТЬЩЋЃЌзюжеБфЮЊКьКжЩЋЙЬЬхMЃЌдђHЪЧFe(OH)2ЁЂMЪЧFe(OH)3ЃЌFe3O4КЭHClЁЂFeЗДгІКѓЕУЕНEЃЌEЮЊFeCl2ЃЌFe(OH)3КЭHClЗДгІЩњГЩWЃЌдђWЪЧFeCl3ЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШЋЙЬЬЌяЎСђЕчГиФмСПУмЖШИпЁЂГЩБОЕЭЃЌЦфЙЄзїдРэШчЭМЫљЪОЃЌЦфжаЕчМЋaГЃгУВєгаЪЏФЋЯЉЕФS8ВФСЯЃЌЕчГиЗДгІЮЊЃК16Li+xS8=8Li2SxЃЈ2ЁмxЁм8ЃЉЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ

A. ЕчГиЙЄзїЪБЃЌИКМЋПЩЗЂЩњЗДгІЃК2Li2S6+2Li++2e-=3Li2S4
B. ЕчГиГфЕчЪБМфдНГЄЃЌЕчГижаЕФLi2S2СПдНЖр
C. ЕчНтжЪжаМгШыСђЫсФмдіЧПЕМЕчад
D. ЕчГиЙЄзїЪБЃЌЭтЕчТЗжаСїЙ§0.02 molЕчзгЃЌИКМЋВФСЯМѕжи0.14 g
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП
18-Ђё
ЯуУЉШЉЃЈ![]() ЃЉПЩзїЮЊКЯГЩЧрняЫиЕФжаМфЬхЃЌЙигкЯуУЉШЉЕФа№Ъіе§ШЗЕФга_______ЁЃ
ЃЉПЩзїЮЊКЯГЩЧрняЫиЕФжаМфЬхЃЌЙигкЯуУЉШЉЕФа№Ъіе§ШЗЕФга_______ЁЃ
AЃЎЗжзгЪНЮЊC10H18O BЃЎВЛФмЗЂЩњвјОЕЗДгІ
CЃЎПЩЪЙЫсадKMnO4ШмвКЭЪЩЋ DЃЎЗжзгжага7жжВЛЭЌЛЏбЇЛЗОГЕФЧт
18-Ђђ
ЕБУбМќСНЖЫЕФЭщЛљВЛЯрЭЌЪБЃЈR1ЃOЃR2ЃЌR1ЁйR2ЃЉЃЌЭЈГЃГЦЦфЮЊЁАЛьУбЁБЁЃШєгУДМЭбЫЎЕФГЃЙцЗНЗЈжЦБИЛьУбЃЌЛсЩњГЩаэЖрИБВњЮяЃК
R1ЁЊOH+ R2ЁЊOH ![]() R1ЁЊOЁЊR2+ R1ЁЊOЁЊR1+ R2ЁЊOЁЊR2+H2O
R1ЁЊOЁЊR2+ R1ЁЊOЁЊR1+ R2ЁЊOЁЊR2+H2O
вЛАугУWilliamsonЗДгІжЦБИЛьУбЃКR1ЁЊX+ R2ЁЊONaЁњR1ЁЊOЁЊR2+NaXЃЌФГПЮЭтбаОПаЁзщФтКЯГЩ![]() ЃЈввЛљмаЛљУбЃЉЃЌВЩгУШчЯТСНЬѕТЗЯпНјааЖдБШЃК
ЃЈввЛљмаЛљУбЃЉЃЌВЩгУШчЯТСНЬѕТЗЯпНјааЖдБШЃК
ЂёЃК![]()
ЂђЃКЂй![]()
Ђк![]()
Ђл![]()
ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉТЗЯпЂёЕФжївЊИБВњЮяга______________ЁЂ______________ЁЃ
ЃЈ2ЃЉAЕФНсЙЙМђЪНЮЊ______________ЁЃ
ЃЈ3ЃЉBЕФжЦБИЙ§ГЬжагІзЂвтЕФАВШЋЪТЯюЪЧ______________ЁЃ
ЃЈ4ЃЉгЩAКЭBЩњГЩввЛљмаЛљУбЕФЗДгІРраЭЮЊ______________ЁЃ
ЃЈ5ЃЉБШНЯСНЬѕКЯГЩТЗЯпЕФгХШБЕуЃК______________ЁЃ
ЃЈ6ЃЉБНМзДМЕФЭЌЗжвьЙЙЬхжаКЌгаБНЛЗЕФЛЙга________жжЁЃ
ЃЈ7ЃЉФГЭЌбЇгУИќЮЊСЎМлвзЕУЕФМзБНЬцДњБНМзДМКЯГЩввЛљмаЛљУбЃЌЧыВЮееТЗЯпЂђЃЌаДГіКЯГЩТЗЯп______________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊЁАдкЗДгІЮяКЭЩњГЩЮяОљЮЊЦјЬхЕФПЩФцЗДгІжаЃЌШєЗДгІЮяАДМЦСПЯЕЪ§БШЭЖСЯ,дђЦНКтЪБВњЮяЕФЬхЛ§ЗжЪ§зюДѓЁБЁЃЖдгк2A2(g)+3B2(g)![]() 2A2B3(g) ІЄH<0ЕФЗДгІ,дкЦфЫќЬѕМўВЛБфЪБЃЌA2B3ЕФЬхЛ§ЗжЪ§(Із)гыA2ЕФЮяжЪЕФСП(n)ЕФЙиЯЕШчЯТЭМЫљЪОЃЌЯТСаЫЕЗЈжае§ШЗЕФЪЧ
2A2B3(g) ІЄH<0ЕФЗДгІ,дкЦфЫќЬѕМўВЛБфЪБЃЌA2B3ЕФЬхЛ§ЗжЪ§(Із)гыA2ЕФЮяжЪЕФСП(n)ЕФЙиЯЕШчЯТЭМЫљЪОЃЌЯТСаЫЕЗЈжае§ШЗЕФЪЧ
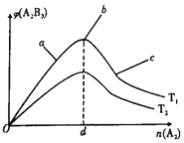
A. T1КЭT2ЕФЙиЯЕЪЧ:T1>T2
B. aЁЂbЁЂcШ§ЕуЖМДІгкЦНКтзДЬЌ;ЕЋе§ЯђЫйТЪзюДѓЕФЪЧaЕу
C. дкn(A2)=dЕФЕу:n(B2)=1.5d
D. aЁЂbЁЂcШ§Еужа:B2ЕФзЊЛЏТЪЫГађЮЊ:b>a>c
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаБфЛЏБиаыМгШыбѕЛЏМСВХФмЪЕЯжЕФЪЧЃЈ ЃЉ
A.Na2SO3ЁњSO2
B.HClЁњCl2
C.H2SO4ЃЈХЈЃЉЁњSO2
D.KMnO4ЁњO2
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвЛЖЈСПЕФCuSКЭCu2SЕФЛьКЯЮяЭЖШызуСПЕФЯЁHNO3ШмвКжаЃЌЪеМЏЕНNOЦјЬхVL(БъзМзДПі),ЯђЗДгІКѓЕФШмвКжа(ДцдкCu2+КЭSO42- )МгШызуСПNaOH,ВњЩњРЖЩЋГСЕэ,Й§ТЫЃЌЯДЕгЃЌзЦЩе,ЕУЕНCuO 12.0g.дђVПЩФмЮЊ
A. 5.5L B. 6.0L C. 8.96L D. 11.2L
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЛЏбЇаЫШЄаЁзщЖдФГЦЗХЦбРИржаФІВСМСГЩЗжМАЦфКЌСПНјаавдЯТЬНОПЃК
ВщЕУзЪСЯЃКЂйИУбРИрФІВСМСгЩЬМЫсИЦЁЂЧтбѕЛЏТСзщГЩЃЛ
ЂкбРИржаЦфЫќГЩЗжгіЕНбЮЫсЪБЮоЦјЬхЩњГЩЁЃ
Ђё.ФІВСМСжаЧтбѕЛЏТСЕФЖЈадМьбщЃКШЁЪЪСПбРИрбљЦЗЃЌМгЫЎГЩЗжНСАшЁЂЙ§ТЫЁЃ
ЃЈ1ЃЉЭљТЫдќжаМгШыЙ§СПNaOHШмвКЃЌЙ§ТЫЁЃЭљЃЈ1ЃЉЫљЕУТЫвКжаЯШЭЈШыЙ§СПЖўбѕЛЏЬМЃЌдйМгШыЙ§СПЯЁбЮЫсЁЃЙлВьЕНЕФЯжЯѓЪЧ____________________ЁЃ
Ђђ.бРИрбљЦЗжаЬМЫсИЦЕФЖЈСПВтЖЈ
РћгУЯТЭМЫљЪОзАжУЃЈЭМжаМаГжвЧЦїТдШЅЃЉНјааЪЕбщЃЌГфЗжЗДгІКѓЃЌВтЖЈCжаЩњГЩЕФBaCO3ГСЕэжЪСПЃЌвдШЗЖЈЬМЫсИЦЕФжЪСПЗжЪ§ЁЃ
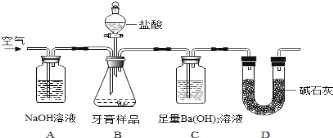
вРОнЪЕбщЙ§ГЬЛиД№ЯТСаЮЪЬтЃК
ЃЈ2ЃЉЪЕбщЙ§ГЬжаашГжајЛКЛКЭЈШыПеЦјЁЃЦфзїгУГ§СЫПЩНСАшBЁЂCжаЕФЗДгІЮяЭтЃЌЛЙга_______ЁЃ
ЃЈ3ЃЉЯТСаИїЯюДыЪЉжаЃЌВЛФмЬсИпВтЖЈзМШЗЖШЕФЪЧ_____________ЃЈЬюБъКХЃЉЁЃ
a.дкМгШыбЮЫсжЎЧАЃЌгІХХОЛзАжУФкЕФCO2ЦјЬх
b.ЕЮМгбЮЫсВЛвЫЙ§Пь
c.дкAЁЋBжЎМфдіЬэЪЂгаХЈСђЫсЕФЯДЦјзАжУ
d.дкBЁЋCжЎМфдіЬэЪЂгаБЅКЭЬМЫсЧтФЦШмвКЕФЯДЦјзАжУ
ЃЈ4ЃЉЪЕбщжазМШЗГЦШЁ8.00gбљЦЗШ§ЗнЃЌНјааШ§ДЮВтЖЈЃЌВтЕУBaCO3ЦНОљжЪСПЮЊ3.94gЁЃдђбљЦЗжаЬМЫсИЦЕФжЪСПЗжЪ§ЮЊ_____________________________ЁЃ
ЃЈ5ЃЉгаШЫШЯЮЊВЛБиВтЖЈCжаЩњГЩЕФBaCO3жЪСПЃЌжЛвЊВтЖЈзАжУCдкЮќЪеCO2ЧАКѓЕФжЪСПВюЃЌвЛбљПЩвдШЗЖЈЬМЫсИЦЕФжЪСПЗжЪ§ЁЃЪЕбщжЄУїАДДЫЗНЗЈВтЖЈЕФНсЙћУїЯдЦЋИпЃЌдвђЪЧ__________ЁЃ
ЃЈ6ЃЉНЋЕШЬхЛ§ЕФAlCl3гыNaOHШмвКЛьКЯЃЌГфЗжЗДгІКѓЃЌВтЕУЛьКЯШмвКжаКЌгаТСдЊЫижЪСПЪЧГСЕэжаКЌгаТСдЊЫижЪСПЕФ2БЖЃЌдђc(AlCl3)гыc(NaOH)ЕФБШжЕЪЧ____________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгУNAБэЪОАЂЗќМгЕТТоГЃЪ§ЕФЪ§жЕЃЌдђЯТСаЫЕЗЈжае§ШЗЕФЪЧЃЈ ЃЉ
A.0.1 mol/L K2SO4 ШмвКжаКЌга K+ЮЊ0.2 NA
B.2.4gУОРызгЫљКЌЕчзгЪ§ФПЮЊNA
C.зуСПЭгы1L2molLЉ1ЯЁСђЫсЗДгІПЩвдЩњГЩH2ЗжзгзмЪ§ЮЊ2NA
D.БъзМзДПіЯТЃЌ44.8 L CCl4жаКЌ2NAИіЗжзг
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПНЋзуСПXЦјЬхЭЈШыYШмвКжаЃЌЪЕбщНсЙћгыдЄВтЕФЯжЯѓвЛжТЕФзщКЯЪЧ
XЦјЬх | YШмвК | дЄВтЕФЯжЯѓ |
| |
Ђй | CO2 | БЅКЭNa2CO3ШмвК | АзЩЋГСЕэЮіГі | |
Ђк | SO2 | Ba(NO3)2ШмвК | АзЩЋГСЕэЮіГі | |
Ђл | Cl2 | AgNO3ШмвК | АзЩЋГСЕэЮіГі | |
Ђм | NH3 | AlCl3ШмвК | АзЩЋГСЕэЮіГі |
A. жЛгаЂйЂкЂл B. жЛгаЂйЂкЂм C. жЛгаЂйЂлЂм D. ЂйЂкЂлЂм
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com