
 +6I—+6H+=R—+3I2+3H2O,n=_____,R元素在
+6I—+6H+=R—+3I2+3H2O,n=_____,R元素在 中的化合价是___ __。
中的化合价是___ __。
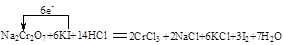 还原剂:KI
还原剂:KI 中的化合价是+(2×3-1)=+5价。
中的化合价是+(2×3-1)=+5价。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源:不详 题型:单选题
| A.①③⑤⑥ | B.②④ | C.②④⑥ | D.①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H2↑+Cl2↑ ______________________________
H2↑+Cl2↑ ______________________________查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该混盐与硫酸反应产生1molC12时转移2NA个电子 |
| B.该混盐的水溶液呈碱性 |
| C.该混盐具有较强的氧化性 |
| D.该混盐中氯元素的化合价为+1和-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在反应中,HCNO既被氧化又被还原 |
| B.在反应中,NO2是氧化剂,HCNO是还原剂 |
| C.在反应中,NO2与HCNO的物质的量之比为1∶1 |
| D.每生成1 mol CO2有4 mol电子转移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com