
【题目】下列推论正确的是( )
A. SiH4的沸点高于CH4,可推测PH3的沸点高于NH3
B. NH4+为正四面体结构,可推测PH4+也为正四面体结构
C. CO2晶体是分子晶体,可推测SiO2晶体也是分子晶体
D. 金刚石熔化时需要破坏共价键,可推测C60熔化时也破坏共价健
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】科学家用氮化镓、铜等材料组装成人工光合系统(如下图),利用该装置成功地实现了以CO2和H2O合成CH4。

(1)写出铜电极表面的电极反应式:_______________________________________________________。
(2)为提高该人工光合系统的工作效率,可向装置中加入少量_________(选填“盐酸”或“硫酸”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异戊二烯是重要的有机化工原料,其结构简式为 ![]() 。
。
异戊二烯的一种制备方法如图所示:
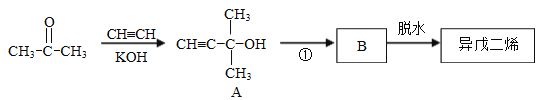
请回答:
(1)A分子中官能团的名称是_______。
(2)①的反应类型是_______。
(3)B的结构简式为___________________________。
(4)写出在一定条件下由异戊二烯制备聚异戊二烯的化学方程式_____________。
(5)设计一条由异戊二烯制得有机合成中间体![]() 的合成路线。
的合成路线。
(合成路线常用的表示方式为:![]() )
)
_____________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:下表为25℃时某些弱酸的电离平衡常数。
CH3COOH | HClO | H2CO3 |
Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
下图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是 ( )

A. 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+) > c(ClO-)> c(CH3COO-)> c(OH-)> c(H+)
B. 向NaClO溶液中通入少量二氧化碳的离子方程式为: ClO-+CO2+ H2O =HClO+CO32-
C. 图像中a、c两点处的溶液中![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
D. 图像中a点酸的总浓度大于b点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用“ Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“ Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2 ![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:

(1)放电时,正极的电极反应式为______________________________________________。
(2)若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e-时,两极的质量差为________ g。
(3)选用高氯酸钠-四甘醇二甲醚作电解液的优点是___________________________________(至少写两点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是工业上以含金、银、铂、铜的金属废料提取金、银、铂的工艺流程。

已知:溶液I中铂和金形成化合物为H[AuC14]和H2[PtCl6]。浓盐酸物质浓度:12mol/L,密度1.179g/cm3;浓硝酸质量分数约为65%,密度约为1.4g/cm3
(1)写出NH4C1的电子式______________。
(2)操作I中金属废料应该连接电源的____极,若另一极采用纯铜,该过程的工业名称为________________。
(3)依据信息和所学知识,王水配制的具体操作为_________________。
(4)通入SO2的作用是__________,SO2不能通入过量的原因是_____________。
(5)阳极泥与王水反应,硝酸被还原为NO,请写出其中一个反应的化学方程式______________。
(6)由银制备银-氯化银参比电极的工作原理如图所示。一段时间后与A连接的电极就会被氯化银覆盖,当乙池中产生0.2g气体时,甲池溶液质量变化为_________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加徳罗常数数值,下列有关叙述正确的是
A. 将78g Na2O2与过量CO2反应转移的电子数为2NA
B. 1molN2与4mol H2反应生成的NH3分子数为2NA
C. 标准状况下,2.24LCCl4中所含原子数为0.5NA
D. 标准状况下,18gD2O中所含电子数为9NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com