
| A. | 2:1 | B. | 1:1 | C. | 2:3 | D. | 1:3 |
分析 根据溶液中氯离子的物质的量浓度=溶质的浓度×电解质电离出的氯离子个数,求出各溶液中Cl-的物质的量浓度,然后求比值.
解答 解:300mL 0.1mol/L KCl溶液中Cl-的物质的量浓度为0.1mol•L-1,100mL 0.1mol/L FeCl3溶液中Cl-的物质的量浓度为0.1mol•L-1×3=0.3mol•L-1,故300mL 0.1mol/L KCl溶液与100mL 0.1mol/L FeCl3溶液中Cl-物质的量浓度之比=0.1mol/L:0.3mol/L=1:3,
故选:D.
点评 本题考查了溶液中离子物质的量浓度的计算,比较基础,注意溶液中溶质离子的浓度与溶液体积无关,只取决于物质电离出的离子的数目多少与溶质的浓度.


科目:高中化学 来源: 题型:选择题
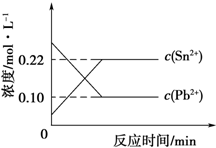 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断不正确的是( )
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断不正确的是( )| A. | 25℃时,该反应的平衡常数K=2.2 | |
| B. | 往平衡体系中加入少量 Sn(NO3)2固体后,c(Pb2+)变大 | |
| C. | 往平衡体系中加入少量金属铅后,c(Pb2+)增大 | |
| D. | 升高温度,平衡体系中c(Pb2+)增大,说明该反应△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二氧化硫、一氧化碳、氮的氧化物、氨气都是非常重要的非金属化合物,研究这些化合物对环境保护、理解化学反应原理都具有重要意义.
二氧化硫、一氧化碳、氮的氧化物、氨气都是非常重要的非金属化合物,研究这些化合物对环境保护、理解化学反应原理都具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应I2(g)+H2(g)?2H I(g) 达平衡后,压缩体积体系颜色变深 | |
| B. | H2O2中加入二氧化锰,生成氧气的速率加快 | |
| C. | 棕黄色的FeCl3溶液中加入铁粉颜色逐渐变为浅绿色 | |
| D. | 反应CO(g)+NO2(g)?CO2(g)+NO(g)△H<0,达平衡后,升高温度体系颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
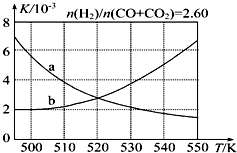 甲醇是重要的化工原料,又可作为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
甲醇是重要的化工原料,又可作为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1 076 | 465 | 413 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4+Ba(OH)2═BaSO4↓+2H2O | B. | 2HCl+Ba(OH)2═BaCl2+2H2O | ||
| C. | H2SO4+Cu(OH)2═CuSO4+2H2O | D. | CH3COOH+NaOH═CH3COONa+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、HCO3-、Cl-、SO42- | B. | Na+、Fe2+、Cl-、SO42- | ||
| C. | Na+、SO42-、Cl-、ClO- | D. | NH4+、Na+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
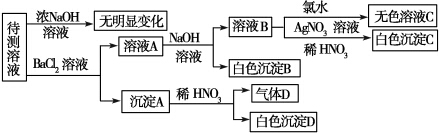
| 肯定存在的离子 | 肯定没有的离子 | 沉淀D | ||
| 化学式或 离子符号 | ||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com