分析:A、用短线“-”代替共用电子对即为结构式,结构式只把共用电子对用短线表示,未成键的电子不画出.
B、高氯酸中氯元素的化合价为+7价,分子式为HClO4.
C、氯化镁是离子化合物,有镁离子和氯离子构成.
D、氯化氢是共价化合物,不存在离子键;氯原子的电子式多1个电子.
解答:解:A、N原子之间形成三对共用电子对,结构式只把共用电子对用短线表示,未成键的电子不画出,N
2的结构式为N≡N,故A错误;
B、高氯酸中氯元素的化合价为+7价,分子式为HClO
4,故B错误;
C、氯化镁是离子化合物,由氯离子和镁离子构成,氯化镁电子式为
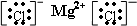
,故C正确;
D、氯化氢是共价化合物,不存在离子键,氢原子与氯原子之间形成1对共用电子对,氯原子最外层有7个电子,氯化氢分子的形成过程:

,故D错误.
故选:C.
点评:本题考查常用化学用语的书写,难度不大,掌握常用化学用语的书写,注意离子化合物、共价键形成的物质的电子式书写.

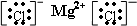 ,故C正确;
,故C正确; ,故D错误.
,故D错误.
