
【题目】碳及其化合物广泛存在于自然界中。回答下列问题:
(1)在基态14C原子中,核外存在______对自旋相反的电子。
(2)碳在形成化合物时,其键型以共价键为主,原因是__________。
(3)CS2分子中,共价键的类型有________,C原子的杂化轨道类型是______,写出两个与CS2具有相同空间构型和键合形式的分子或离子_______。
(4)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
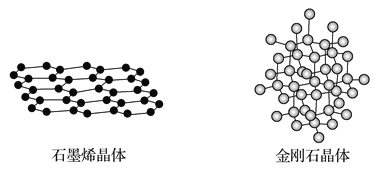
①在石墨烯晶体中,每个C原子连接_____个六元环,每个六元环占有___个C原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接_____个六元环,六元环中最多有______个C原子在同一平面。
【答案】2 C有4个价电子且半径小,难以通过得或失电子达到稳定电子结构 σ键和π键 sp CO2、SCN-(或COS等,) 3 2 12 4
【解析】
(1)根据同一轨道的2两个电子自旋方向相反判断;
(2)共价键为原子之间以共用电子对成键,碳原子有4个价电子,且半径较小,反应中难以失去或得到电子;
(3)CS2分子的结构式为S=C=S,含有σ键和π键;结合σ键和孤对电子数判断价层电子对数,以此判断杂化类型;根据等电子体进行判断;
(4)石墨晶体中最小的环为六元环,每个碳原子形成3个C-C键,每个C-C键被2个碳原子共用;在金刚石晶体中,每个C原子与周围的4个碳原子形成四个碳碳单键,最小的环为六元环,每个单键为三个环共有。
(1)基态C原子核外电子排布式为1s22s22p2,轨道排布式为:![]() ,则在基态14C原子中,核外存在2对自旋相反的电子;
,则在基态14C原子中,核外存在2对自旋相反的电子;
(2)共价键为原子之间以共用电子对成键,碳原子有4个价电子,且半径较小,反应中难以失去或得到电子,故碳在形成化合物时,其键型以共价键为主;
故答案为:C有4个价电子且半径小,难以通过得或失电子达到稳定电子结构;
(3)CS2分子的结构式为S=C=S,含有σ键和π键,CS2分子中C原子形成2个σ键,孤对电子数为![]() =0,则C为sp杂化;
=0,则C为sp杂化;
O与S同主族,所以与CS2具有相同空间构型和键合形式的分子为CO2或COS等;与CO2互为等电子体的离子有SCN-,所以SCN-的空间构型与CS2键合方式与相同;
(4)①石墨晶体中最小的环为六元环,每个碳原子形成3个C-C键,则每个C原子连接 3个六元环,每个六元环占有的C原子数为6×![]() =2;
=2;
②在金刚石晶体中,每个C原子与周围的4个碳原子形成四个碳碳单键,最小的环为六元环,每个单键为三个环共有,则每个C原子连接4![]() 3=12个六元环,晶胞中共平面的原子如图
3=12个六元环,晶胞中共平面的原子如图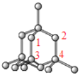 ,共4个。
,共4个。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】化合物E(二乙酸-1,4-环己二醇酯)是一种制作建筑材料的原料。其合成路线如下:
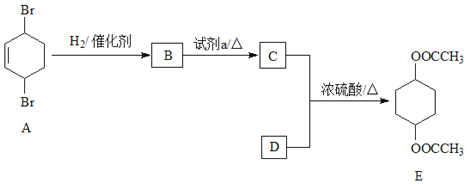
完成下列填空:
(1)A中含有的官能团是______;E的分子式是______;试剂a是______。
(2)写出反应类型:B→C______。
(3)C与D反应生成E的化学方程式:______。
(4)C的同分异构体,能使石蕊试剂显红色,写出该物质的一种结构简式______。
(5)设计一条以环己醇(![]() )为原料(其他无机试剂任取)合成A的合成路线。
)为原料(其他无机试剂任取)合成A的合成路线。
(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)_____________________
目标产物)_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C5H7Cl的有机物,其结构不可能是( )
A. 分子中只有一个双键
B. 分子中可能有两个双键
C. 分子中可能含有一个叁键
D. 分子中可能含有一个双键和一个环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示的装置研究SO2的性质:
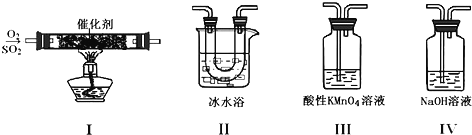
已知:
物质 | 熔点℃ | 沸点℃ |
SO2 | -76.1 | -10 |
SO3 | 16.8 | 45 |
(1)装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式________________。
(2)甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是___;观察到装置Ⅲ中现象是________________,说明二氧化硫具有___性
(3)乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置(装置Ⅱ中充分冷却),若装置Ⅳ中有40mL2.5mol/LNaOH溶液,反应后增重4.8g,则装置Ⅳ中发生反应的总的化学方程式是___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知煤的近代结构模型如图所示。

回答下列问题:
(1)从煤的结构模型来看,煤是工业上获得____________的重要来源。
(2)我国大约70%的煤是直接用于燃烧的。从煤的结构模型来看,在提供热量的同时产生大量的____________、____________等气体物质,造成严重的大气污染。
(3)“型煤”技术不仅可以减少87%的废气排放量,烟尘排放量也可减少80%,致癌物苯并[α]芘的排放量也减少,同时节煤20%~30%。“型煤”技术的原理是利用固硫剂在燃烧过程中生成稳定的硫酸盐。某“型煤”生产厂利用石灰石作固硫剂,试用化学方程式表示其固硫过程________________、________________。
(4)为了解决煤燃烧所造成的污染问题和提高煤的利用价值,煤资源的综合利用方法还有____________、____________、____________等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证氧化性:Cl2>Fe3+>SO2,某化学研究性学习小组用如图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕):
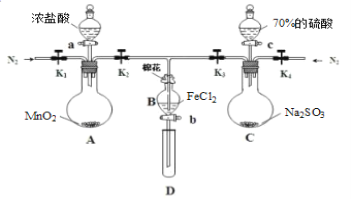
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的阳离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是_____________。
(2)棉花中浸润的溶液为________________,作用是____________ 。
(3)导致步骤Ⅲ中溶液变黄的离子反应是__________,用________(写试剂化学式)检验氧化产物,现象是____________。
(4)能说明氧化性Fe3+>SO2的离子方程式是___________。
(5)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性:Cl2>Fe3+>SO2的是_______(填“甲”“乙”“丙”)。
过程Ⅳ,B溶液中含有的离子 | 过程Ⅵ,B溶液中含有的离子 | |
甲 | 有Fe3+无Fe2+ | 有 |
乙 | 既有Fe3+又有Fe2+ | 有 |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用“价类二维图”研究物质的性质是化学研究的重要手段。如图是氯元素的化合价与部分物质类别的对应关系。

回答下列问题:
(1)X的电离方程式为_________。
(2)氯的某种氧化物(ClmOn)中氯、氧元素质量比为71:48,则m:n= _________。
(3) NaClO有较强的氧化性,所以是常用的消毒剂和漂白剂,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式_____________。
(4)NaClO2具有很强的氧化性,常用作消毒剂,其消毒效率是Z的 ___________倍(还原产物都为Cl-,消毒效率以单位物质的量得到的电子数表示)。
(5)Cl2O可用潮湿的Z与Na2CO3反应制取,同时生成NaHCO3,反应中Z既体现氧化性,又体现还原性,该反应的化学方程式为_____________。
(6)自来水中的![]() 对人类健康产生危害。为了降低自来水中
对人类健康产生危害。为了降低自来水中![]() 的浓度,某研究人员提出在碱性条件下用Al粉还原
的浓度,某研究人员提出在碱性条件下用Al粉还原![]() ,产物是N2。发生的反应可表示如下,请完成方程式的配平:___Al+ ____
,产物是N2。发生的反应可表示如下,请完成方程式的配平:___Al+ ____![]() + _____=___
+ _____=___![]() + _____ N2↑ + _______H2O
+ _____ N2↑ + _______H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下:

(1)将过程②中的产生的气体通入下列溶液中,溶液会褪色的是________。
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS和O2、H2SO4反应的离子方程式为:________。
(3)过程③中,需加入的物质是________。
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有___________。
(5)过程⑤调节pH可选用下列试剂中的________(填选项序号)。
A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70~80℃,目的是___________。
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2.800 g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥、称量,得固体质量为3.495 g。若该聚铁主要成分为[Fe(OH)(SO4)]n,则该聚铁样品中铁元素的质量分数为________。(假设杂质中不含铁元素和硫元素)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com