
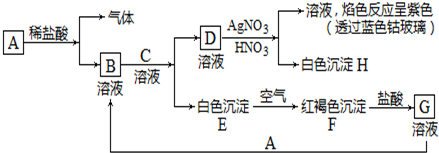
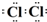 ���÷�Ӧ�����ӷ���ʽ��MnO2+4H++2Cl-$\frac{\underline{\;\;��\;\;}}{\;}$Mn2++Cl2��+2H2O��
���÷�Ӧ�����ӷ���ʽ��MnO2+4H++2Cl-$\frac{\underline{\;\;��\;\;}}{\;}$Mn2++Cl2��+2H2O������ ��1����Y�ǻ���ɫ���壬��YΪ������A��B�����ʵ���֮��Ϊ1��4�����ʵ���ҳ���Ũ������������̷�Ӧ����ȡ���������
��2��AΪ�ǽ������ʣ���������ԭ�Ӻ��������������Ǵ�����������2������Ϊ2�����Ӳ㣬���һ�������Ϊ2���ڶ��������Ϊ4����AΪ̼Ԫ�أ�A��B�����ʵ���֮��Ϊ1��4����÷�ӦΪ̼��Ũ���ᷴӦ��Ȼ������Ԫ�صĻ��ϼ۷�����
��3��AΪ�������ʣ�������A��B��Ũ��Һ�С��ۻ�������AΪ��������BΪŨ�����Ũ���ᣬ��A������X��Һ����AΪ������A��B�����ʵ���֮��Ϊ1��4���÷�ӦΪ����ϡ���ᷴӦ������������һ��������ˮ����������ԭ������������λ�ã��������������������ķ�Ӧ����Һ�����ֽ��������ӵ����ʵ���ǡ����������㱻��ԭ����������
��4����A��Һ�м��������ữ��AgNO3��Һ��������ɫ��������A�к��������ӣ�B����ɫΪ��ɫ����B�к�����Ԫ�أ�A��B�����ʵ���֮��1��4ǡ�÷�Ӧ����÷�ӦΪ�Ȼ������������Ƶķ�Ӧ�����÷�Ӧ�и����ʵ�����ƫ�����Ƶ�ˮ����������
��� �⣺��1�������ɫ����Ϊ��������ԭ�������7�����ӣ��������д���һ�Թ��õ��Ӷԣ������ʽΪ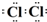 ��A��B�����ʵ���֮��Ϊ1��4��
��A��B�����ʵ���֮��Ϊ1��4��
��ӦΪMnO2+4H++2Cl-$\frac{\underline{\;\;��\;\;}}{\;}$ Mn2++Cl2��+2H2O���ʴ�Ϊ��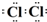 ��MnO2+4H++2Cl-$\frac{\underline{\;\;��\;\;}}{\;}$ Mn2++Cl2��+2H2O��
��MnO2+4H++2Cl-$\frac{\underline{\;\;��\;\;}}{\;}$ Mn2++Cl2��+2H2O��
��2��AΪ�ǽ������ʣ���������ԭ�Ӻ��������������Ǵ�����������2������Ϊ2�����Ӳ㣬���һ�������Ϊ2���ڶ��������Ϊ4�������������ڵ���������6����AΪ̼Ԫ�أ�A��B�����ʵ���֮��Ϊ1��4����÷�ӦΪ̼��Ũ���ᷴӦ���䷴ӦΪC+4HNO3�TCO2��+4NO2��+2H2O���ɻ��ϼۿ�֪̼Ԫ�صĻ��ϼ����ߣ���̼����ԭ���������е�Ԫ�صĻ��ϼ۽��ͣ������������������ɻ�ѧ��������֪�������뻹ԭ�������ʵ���֮��Ϊ4��1���ʴ�Ϊ��4��1��
��3��AΪ�������ʣ�������A��B��Ũ��Һ�С��ۻ�������AΪ��������BΪŨ�����Ũ���ᣬ��A������X��Һ����AΪ������A��B�����ʵ���֮��Ϊ1��4���÷�ӦΪ����ϡ���ᷴӦ������������һ��������ˮ��
����Ϊ26��Ԫ�أ�����Ԫ�����ڱ��еĵ�4���ڢ��壬����ϡ���ᷴӦ���ɵ�YΪNO���ʴ�Ϊ����4���ڢ��壻NO��
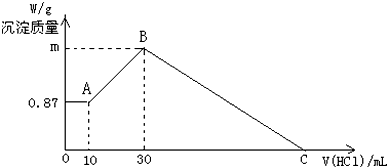
���豻��ԭ�������������ʵ���Ϊx����
2Fe3++Fe�T3Fe2+��
2 3
x $\frac{3x}{2}$
����Һ�����ֽ��������ӵ����ʵ���ǡ����ȣ���a-x=$\frac{3x}{2}$�����x=0.4a���ʴ�Ϊ��0.4a��
��4����A��Һ�м��������ữ��AgNO3��Һ��������ɫ��������A�к��������ӣ�B����ɫΪ��ɫ����B�к�����Ԫ�أ�A��B�����ʵ���֮��1��4ǡ�÷�Ӧ����÷�ӦΪ�Ȼ������������Ƶķ�Ӧ���䷴ӦΪAlCl3+4NaOH=3NaCl+NaAlO2+2H2O����Ȼ��A��B�����ʵ����ֱ�Ϊ1mol��4mol����������4mol��������3mol��ƫ�����������С��1mol����ƫ���������ˮ������Һ�Լ��ԣ���c��OH-����c��H+���������Ӵ�СΪc��Na+����c��Cl-����c��AlO2-����c��OH-����c��H+����
�ʴ�Ϊ��c��Na+����c��Cl-����c��AlO2-����c��OH-����c��H+����
���� ������ѣ�����֪ʶ��϶࣬ѧ��Ӧ��Ϥ������������ԭ��Ӧ���������ʵ������ǽ����Ĺؼ��������������ӷ���ʽ��ѧ��Ӧ����ʽ������������⣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 500mL��0.2mol/L ��NaCl��Һ | B�� | 1 000 mL��0.1mol/L ��MgCl2��Һ | ||
| C�� | 50 mL��0.2mol/L ��CaCl2��Һ | D�� | 100 mL��0.1mol/L ��AlCl3��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ȶ��ԣ�H2S��HCl | B�� | ���Ӱ뾶��Na+��F- | ||
| C�� | ���ԣ�H2SO4��HClO4 | D�� | ���ӻ�ԭ�ԣ�S2-��Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
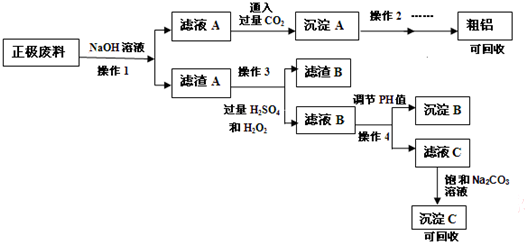
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���� | B�� | �ϳ��� | C�� | �ϳ���ά | D�� | ���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com