
| A. | 1.6 mol | B. | 2.8 mol | C. | 6.4 mol | D. | 3.6 mol |
分析 根据c=$\frac{n}{V}$,v=$\frac{△c}{△t}$,及化学反应速率之比等化学计量数之比进行计算.
解答 解:10s内A的反应速率为0.12mol/(L•s),则参加反应的A的物质的量浓度为0.12mol/(L•s)×10s=1.2mol/L,故参加反应的A的物质的量为1.2mol/L×2L=2.4mol,则参加反应的B的物质的量为$\frac{2.4mol}{3}$=0.8mol,生成C的物质的量为0.8mol×2=1.6mol,故10s后容器内的总物质的量为4mol-2.4mol+4mol-0.8mol+1.6mol=6.4mol,
故选C.
点评 本题考查化学反应速率及物质的量浓度的相关计算,把握化学反应速率的定义和化学反应速率之比等化学计量数之比为解答的关键,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
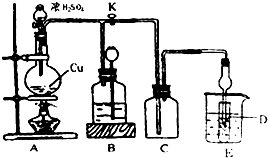
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴入KSCN溶液显红色的溶液中:K+、Fe2+、SO42-、Cl- | |
| B. | 1 mol•L-1的烧碱溶液中:S2-、SO32-、SO42-、K+ | |
| C. | 使淀粉碘化钾试纸变蓝的溶液:Cs+、Ba2+、S2-、Cl- | |
| D. | 含有大量HCO3-的澄清透明溶液中:K+、NH4+、SO42-、MnO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1gH2所含的原子个数 | |
| B. | 4g氮气所含的原子个数 | |
| C. | 16gO2所含的分子个数 | |
| D. | 23g金属Na全部转变为金属离子时失去的电子个数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③② | B. | ②①③ | C. | ③②① | D. | ③①② |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com