
| A. | 采取低碳、节俭的生活方式 | |
| B. | 工业生产中用NaOH溶液吸收氮的氧化物 | |
| C. | 用风能、太阳能代替部分火力发电 | |
| D. | 食品工业生产中选用SO2作为漂白剂 |
分析 A.依据节能减排的原则解答;
B.氮的氧化物多数有毒,能够与氢氧化钠溶液反应;
C.用风能发电、水利发电和太阳能发电代替火力发电,能减少二氧化碳的排放;
D.二氧化硫有毒.
解答 解:A.采取低碳、节俭的生活方式,节省大量的能源,保护环境,符合保护环境的措施,故A正确;
B.氮的氧化物多数有毒,能够与氢氧化钠溶液反应,工业生产中用NaOH溶液吸收氮的氧化物,防止空气污染,故B正确;
C.用风能发电、水利发电和太阳能发电代替火力发电,能减少二氧化碳的排放,有利于环境保护,故C正确;
D.二氧化硫有毒,不能用于食品漂白,故D错误;
故选:D.
点评 本题考查了生产生活中的化学知识,低碳环保理念已成为人们的共识,节能减排的措施和观念是化学考查的热点,要用低碳环保理念指导自己的活动,把节能减排的措施运用到生产、生活中去.


科目:高中化学 来源: 题型:选择题
| A. | C2H6O | B. | C2H4O2 | C. | CH4O | D. | C4H10O? |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 难溶电解质的溶度积Ksp越小,则它的溶解度越小 | |
| B. | 任何难溶物在水中都可以存在沉淀溶解平衡,给定温度的溶解度大小都可以用Ksp计算出来 | |
| C. | 溶度积常数Ksp与温度有关,温度越高,溶度积越大 | |
| D. | 升高温度,某沉淀溶解平衡逆向移动,说明它的溶解度是减小的,Ksp也变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制备环己酮的反应原理:
实验室制备环己酮的反应原理: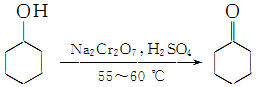 (实验装置如图所示,环己醇、环己酮、饱和食盐水和水的部分物理性质见表).
(实验装置如图所示,环己醇、环己酮、饱和食盐水和水的部分物理性质见表).| 物质 | 沸点(℃) | 密度(g•cm-3,20℃) | 溶解性 |
| 环己醇 | 161.1 | 0.962 | 能溶于水 |
| 环己酮 | 155.6 | 0.948 | 微溶于水 |
| 饱和食盐水 | 108.0 | 1.330 | - |
| 水 | 100.0 | 0.998 | - |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑥⑦⑧ | B. | ①⑤⑧ | C. | ①④⑤⑦ | D. | ①④⑤⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | 盐酸:强电解质 | Cl2:非电解质 | CaCO3:弱电解质 |
| B | CuSO4•5H2O:纯净物 | Al(OH)3:一元酸 | HD:单质 |
| C | Al2O3:离子化合物 | NaHCO3:正盐 | Na2O2:碱性氧化物 |
| D | 血液:胶体 | NO2:酸性氧化物 | H2O和D2O:混合物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .(铋元素与氮元素同主族)
.(铋元素与氮元素同主族)查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲装置:可用来证明碳酸的酸性比硅酸强 | |
| B. | 乙装置:橡皮管的作用是能使水顺利流下 | |
| C. | 丙装置:用图示的方法不能检查此装置的气密性 | |
| D. | 丁装置:先从①口进气集满二氧化碳,再从②口进气,可收集氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2υ(正)(X)=3υ(逆)(Z) | B. | 混合气体的总质量不变 | ||
| C. | 混合气体的密度不变 | D. | △H的数值不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com