
| A. | 化学反应的实质是旧化学键的断裂和新化学键的形成 | |
| B. | 分解反应都是吸热反应,化合反应都是放热反应 | |
| C. | 若反应放热,则反应物的总能量大于生成物的总能量 | |
| D. | 利用化学反应可以合成自然界中不存在的物质 |
分析 A、根据化学反应的实质分析判断.
B、化合反应有的是吸热反应,分解反应有的也是放热反应;
C、根据放热反应反应物总能量大于生成物总能量;
D、人们通过有机合成可以获得自然界存在的有机物,还可以合成自然界中不存在的物质.
解答 解:A、化学反应的实质就是旧化学键的断裂和新化学键的形成,故A正确.
B、一般化合反应放热,分解反应吸热.如:2H2O2=2H20+O2 放热、N2+3H2=2NH3 吸热(可逆反应),故B错误;
C、因放热反应反应物总能量大于生成物总能量,故C正确;
D、人们通过有机合成可以获得自然界存在的有机物,还可以合成自然界中不存在的物质,故D正确.
故选B.
点评 本题考查了化学反应的实质、吸放热反应的判断以及化学反应的意义等知识点,难度不大.


科目:高中化学 来源: 题型:解答题
 水是人类赖以生存不可缺少的物质,水质优劣直接影响人体健康,为了探究水质优劣,某综合实验小组来自来水厂参观,了解到源水处理成自来水的工艺流程示意图如图所示:
水是人类赖以生存不可缺少的物质,水质优劣直接影响人体健康,为了探究水质优劣,某综合实验小组来自来水厂参观,了解到源水处理成自来水的工艺流程示意图如图所示:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅酸盐材料的应用历史非常悠久,其中玻璃是人类最早应用的 | |
| B. | 水泥是一种重要的建筑材料,制备水泥和玻璃都需要用到石英 | |
| C. | 普通玻璃的主要成分是硅酸钠、硅酸钙和二氧化硅 | |
| D. | 玻璃钢和钢都属于复合材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期律的实质是元素原子的核外电子排布呈周期性变化 | |
| B. | 利用元素周期律可以预测元素及其化合物的性质 | |
| C. | 元素周期表有7个横行,也就是7个周期 | |
| D. | 元素周期表有18个纵列,也就是18个族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2C═CH2+H2$\stackrel{催化剂}{→}$H3C-CH3 | |
| B. | 2CH3CH2OH+O2$\stackrel{Cu/△}{→}$2CH3CHO+2H2O | |
| C. | 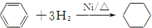 | |
| D. | 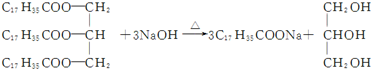 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 奥运场馆“鸟巢”使用的代号为Q460的特殊钢是合金 | |
| B. | 乙醇是可再生的燃料,车用乙醇汽油值得提倡 | |
| C. | 复合材料一般有强度高、质量轻、耐高温、耐腐蚀等优异性能 | |
| D. | 含植物营养元素氮、磷的生活污水有利于水生植物成长,可以净化天然水体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com