
| A、FeS |
| B、CuS |
| C、Fe3O4 |
| D、Al2S3 |


科目:高中化学 来源: 题型:
| A、14N、N4与N2互为同位素 |
| B、N4H4(SO4)2的电离方程式为N4H4(SO4)2?N4H44++2SO42- |
| C、NH4+与SO42-中心原子的杂化方式均为“sp3”杂化 |
| D、N4H4(SO4)2中只含有共价键,不含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
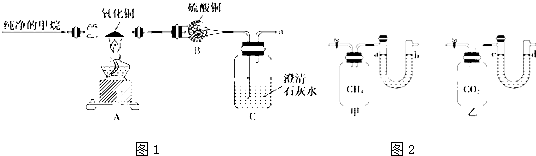
查看答案和解析>>
科目:高中化学 来源: 题型:
 铜合金及铜的氯化物在生产生活中有着广泛的应用.请回答下列问题:
铜合金及铜的氯化物在生产生活中有着广泛的应用.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| A、283kJ |
| B、110kJ |
| C、196.5kJ |
| D、56.6kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al2(SO4)3和氨水 |
| B、Na2CO3和稀盐酸 |
| C、NaCl和AgNO3 |
| D、盐酸和NaAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
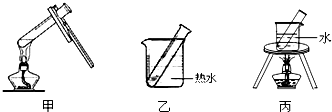
| 实验变量 实验序号 | 银氨溶液的量/mL | 乙醛的量/滴 | 温度/℃ | 反应混合液的pH | 出现银镜的时间/min |
| 1 | 1 | 3 | 65 | 11 | 5 |
| 2 | 1 | 3 | 45 | 11 | 6.5 |
| 3 | 1 | 5 | 65 | 11 | 4 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com