
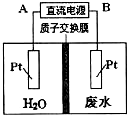
 用如图所示装置处理含NO3-的酸性工业废水,某电极反应式为2NO3-+12H++10e-=N2+6H2O,则下列说法错误的( )
用如图所示装置处理含NO3-的酸性工业废水,某电极反应式为2NO3-+12H++10e-=N2+6H2O,则下列说法错误的( )| A、电源正极为A,电解过程中有气体放出 |
| B、电解时H+从质子交换膜左侧向右侧移动 |
| C、电解过程中,右侧电解液pH保持不变 |
| D、电解池一侧生成5.6g N2,另一侧溶液质量减少l8g |
| 5.6g |
| 28g/mol |


科目:高中化学 来源: 题型:
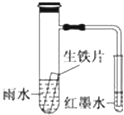 双鸭山一中某化学兴趣小组研究酸雨对生铁腐蚀情况的实验如下:图示小试管内为红色的墨水,具支试管中为pH=4.5放置一段时间的雨水和生铁.实验观察到:初期导管内液面下降,后来导管内液面回升,略高于小试管内液面.下列说法正确的是( )
双鸭山一中某化学兴趣小组研究酸雨对生铁腐蚀情况的实验如下:图示小试管内为红色的墨水,具支试管中为pH=4.5放置一段时间的雨水和生铁.实验观察到:初期导管内液面下降,后来导管内液面回升,略高于小试管内液面.下列说法正确的是( )| A、生铁片中的碳是原电池的负极,发生还原反应 |
| B、雨水酸性较强,生铁片始终发生析氢腐蚀 |
| C、墨水回升时,碳电极反应式为O2+2H2O+4e-═4OH- |
| D、具支试管中溶液酸性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应可能是化合反应,也可能是氧化还原反应 |
| B、该反应一定是复分解反应,且属于非氧化还原反应 |
| C、该反应可能是CaCl2+Na2CO3═CaCO3↓+2NaCl |
| D、该反应可能是Ca(OH)2+K2CO3═CaCO3↓+2KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
| A、该反应的△H>0 |
| B、加压、增大H2浓度和加入催化剂都能提高CO的转化率 |
| C、工业上采用5×103kPa和250℃的条件,其原因是原料气的转化率高 |
| D、t℃时,向1 L密闭容器中投入0.1 mol CO和0.2 mol H2,平衡时CO转化率为50%,则该温度时反应的平衡常数的数值为100 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子序数由大到小的顺序为Z<Y<X |
| B、Y元素最高价氧化物对应水化物的化学式可表示为H3YO4 |
| C、3种元素的气态氢化物中Z的气态氢化物最稳定 |
| D、原子半径由大到小的顺序为Z>Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定条件下,2molSO2和1molO2混合在密闭容器中充分反应后容器中的分子数大于2NA |
B、256g S8分子中含S-S键为7NA个  |
| C、由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个 |
| D、1 mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数为NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
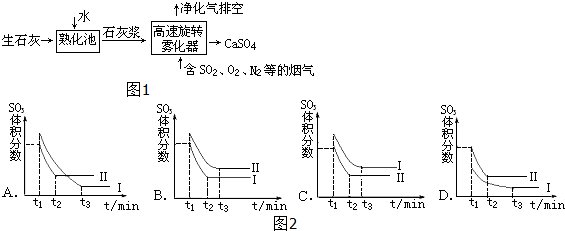
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com