
【题目】NA为阿伏伽德罗常数,下列叙述正确的是( )
A. 室温下,lLpH=13的NaOH溶液中,由水电离的OH-数目为0.1NA
B. 标准状况下,2.24LCl2通入水中充分反应,转移电子数目0.1NA
C. 常温常压下,42g乙烯和丁烯混合气体中,含原子数目为9NA
D. 氢氧燃料电池正极消耗22.4L (标准状况)气体时,电路中通过的电子数目为2NA
科目:高中化学 来源: 题型:
【题目】根据下列高分子化合物回答问题:
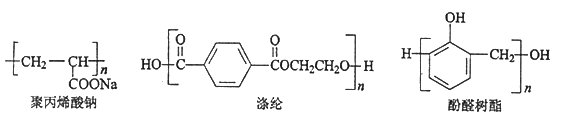
(1)合成聚丙烯酸钠的单体的结构简式是__________,反应类型是__________;
(2)合成涤纶有两种单体,其中能和NaHCO3反应的单体的结构简式是__________,其核磁共振氢谱的峰面积比是_________;
(3)①合成酚醛树脂需要两种单体,和这两种单体均可以发生反应的试剂是__________(填字母序号);
a. H2 b. Na c. Na2CO3 d. 溴水
② 和乙醛在酸性条件下也可以发生类似于制备酚醛树脂的反应,此反应的化学方程式是____________________。
和乙醛在酸性条件下也可以发生类似于制备酚醛树脂的反应,此反应的化学方程式是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2015四川卷】(NH4)2SO4是常见的化肥和化工原料,受热易分解。某兴趣小组拟探究其分解产物。
[查阅资料] (NH4)2SO4在260℃和400℃时分解产物不同。
[实验探究]该小组拟选用下图所示装置进行实验(夹持和加热装置略)
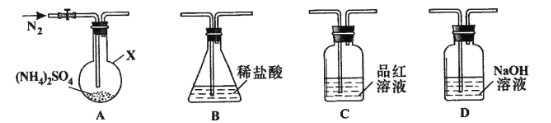
实验1:连接装置A-B-C-D,检查气密性,按图示加入试剂(装置B盛0.5000mol/L盐酸70.00mL)。通入N2排尽空气后,于260℃加热装置A一段时间,停止加热,冷却,停止通入N2。品红溶液不褪色,取下装置B,加入指示剂,用0.2000mol/L NaOH溶液滴定剩余盐酸,终点时消耗NaOH溶液25.00 mL。经检验滴定后的溶液中无SO42-。
(1)仪器X的名称是________________。
(2)滴定前,下列操作的正确顺序是_________(填字母编号)。
a.盛装0.2000mol/L NaOH溶液 b.用0.2000mol/L NaOH溶液润洗
c.读数、记录 d.查漏、清洗 e.排尽滴定管尖嘴的气泡并调整液面
(3)装置B内溶液吸收气体的物质的量是__________mol
实验2:连接装置A-D-B,检查气密性,按图示重新加入试剂。通入N2排尽空气后,于400℃加热装置A至(NH4)2SO4完全分解无残留物,停止加热,冷却,停止通入N2。观察到装置A、D之间的导气管内有少量白色固体。经检验,该白色固体和装置D内溶液中有SO32-,无SO42-。进一步研究发现,气体产物中无氮氧化物。
(4)检验装置D内溶液中有SO32-,无SO42-的实验操作和现象是__________.
(5)装置B内溶液吸收的气体是____________.
(6)(NH4)2SO4在400℃分解的化学方程式是______________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知信息:[Cu(NH3)4]SO4的电离方程式:[Cu(NH3)4]SO4 ==[Cu(NH3)4]2++SO42。具有6个配体的Co3+的配合物CoClm·nNH3,若1 mol此配合物与足量的AgNO3溶液反应只生成2 mol AgCl沉淀,则m、n的值分别是( )
A. m=3,n=4 B. m=3,n=3 C. m=5,n=1 D. m=3,n=5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用元素周期律解释的是
A. 酸性:HClO4 > H2SO3 B. 碱性:NaOH > Mg(OH)2
C. 气态氢化物的稳定性:H2O > H2S D. Cl2从NaBr溶液中置换出Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法确的是
A. 水可用来鉴别溴苯和苯
B. 聚苯乙烯不能发生加成反应
C. 用于杀菌消毒的医用酒精质量分数为95%
D. 植物油,动物脂肪和甘油都属于油脂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.沉淀的生成、溶解和转化在无机物制备和提纯以及科研等领域有广泛应用。
(1)已知25℃时,Ksp(BaSO4)=1×10-10,将BaSO4的悬浊液过滤,滤液中c(Ba2+)=_______mol·L-1。取100 mL滤液与100 mL 2 mol·L-1的Na2SO4溶液混合,混合液中c(Ba2+)=___________ mol·L-1。
(2)长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率。水垢中含有的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。
①CaSO4转化为CaCO3的离子方程式为:_____________________________________________________
②请分析CaSO4转化为CaCO3的原理:______________________________________________________
Ⅱ.在25 ℃时,HSCN、HClO、H2CO3的电离常数如下表:
HClO | HSCN | H2CO3 |
K=3.2×10-8 | K=0.13 | K1=4.2×10-7 K2=5.6×10-11 |
(1)1 mol·L-1的KSCN溶液中,所有离子的浓度由大到小的顺序为_________________________________
(2)向Na2CO3溶液中加入过量HClO溶液,反应的化学方程式为_______________________________
(3)25 ℃时,为证明HClO为弱酸,某学习小组的同学设计了以下三种实验方案。下列三种方案中,你认为能够达到实验目的的是______________________(填下列各项中序号)。
a.用pH计测量0.1mol·L-1NaClO溶液的pH,若测得pH>7,可证明HClO为弱酸
b.用pH试纸测量0.01 mol·L-1 HClO溶液的pH,若测得pH>2,可证明HClO为弱酸
c.用仪器测量浓度均为0.1 mol·L-1的HClO溶液和盐酸的导电性,若测得HClO溶液的导电性弱于盐酸,可证明HClO为弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅,三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
石英砂![]() 粗硅
粗硅![]() SiHCl3(粗)
SiHCl3(粗)![]() SiHCl3(纯)
SiHCl3(纯)![]() 高纯硅
高纯硅
①写出由纯SiHCl3制备高纯硅的化学反应方程式:_____________。
②整个制备过程必须严格控制无水、无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出这一过程的化学反应方程式:__;H2还原SiHCl3过程中若混入O2,可能引起的后果是__________。
(2)下列有关硅材料的说法正确的是_____(填字母)。
A.碳化硅化学性质稳定,可用于生产砂纸、砂轮的磨料
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com