
| A��ԭ��Һ�к��еĽ���������ֻ��Fe2+��Cu2+ |
| B���ù���ԭ��ʹ�õ�FeCl3��Һ�����ʵ���Ũ��ԼΪ2 mol/L |
| C������500 mL��Һ�м���������ϡHNO3��Һ���ڱ���²���NO����4.48 L����ԭ��Һ��Fe2+��Cu2+�����ʵ���Ũ��֮��Ϊ2��1 |
| D������ʹ�����軯����Һ����÷�Һ���Ƿ���Fe2+ |
| n |
| V |
| 43.05 |
| 143.5 |
| 1 |
| 3 |
| 1 |
| 3 |
| 0.1 |
| 0.05 |


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
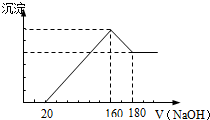 ��һ��������þ���Ͻ�Ͷ��100mLһ��Ũ�ȵ������У��Ͻ���ȫ�ܽ⣮�������� Һ�еμ�Ũ��Ϊ5mol/L��NaOH��Һ�����ɵij����������NaOH��Һ�������ϵ��ͼ���������������λ��mL��������������λ��g����Ӧ�������漰�Ļ�ѧ����ʽ
��һ��������þ���Ͻ�Ͷ��100mLһ��Ũ�ȵ������У��Ͻ���ȫ�ܽ⣮�������� Һ�еμ�Ũ��Ϊ5mol/L��NaOH��Һ�����ɵij����������NaOH��Һ�������ϵ��ͼ���������������λ��mL��������������λ��g����Ӧ�������漰�Ļ�ѧ����ʽ�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������ȼ�ղ�һ���Ƿ��ȷ�Ӧ |
| B�����ȷ�Ӧ����Ҫ����������κ��������ܷ��� |
| C����һ��ȷ���Ļ�ѧ��Ӧ�У���Ӧ�����������Ǹ��������������� |
| D����ѧ��Ӧ���������µ������⣬�������������ı仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������¶� |
| B�������ܱ��������ݻ� |
| C��ʹ�ô��� |
| D������ѹǿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��2.8g ��ϩ���ϩ�Ļ�����к�̼ԭ�ӵ���ĿΪ 0.2NA |
| B��2.3g�ױ��ͱ������Ļ�����У�����ԭ����ĿΪ0.2NA |
| C��1 mol C3H8 �����к��й��ۼ�����ĿΪ 10 NA |
| D����״���£�11.2 L����ϩ�к��еĹ��õ��Ӷ���ΪNA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������� | B�������� |
| C�������� | D���������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com