
含氯消毒剂和过氧化物等强氧化性消毒剂可防甲型H1N1流感。
(1)过碳酸钠是一种有多种用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。
①H2O2有时可作为矿业废液消毒剂,如消除采矿业废液中的氰化物(如NaCN),经以下反应实现:NaCN+H2O2+H2O=A+NH3↑,则生成物A的化学式______________
②某强酸性反应体系中,反应物和生成物共六种物质:
O2、MnO4-、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→ O2。
写出该反应的离子方程式:_______________________________________________。
(2)某天然碱的化学式可表示为:aNa2CO3·bNaHCO3·2H2O,取m g天然碱溶于水配成溶液,再向溶液中逐滴加入1 mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系某同学作出了如图所示的A和B曲线,试回答下列问题:
①_______曲线正确,天然碱的化学式为___________,
②加盐酸后产生CO2气体体积(标准状况)的最大值为 _____________mL。
(3) 常温下用氧缺位铁酸锌ZnFe2Oy可以消除NOx污染,使NOx转变为N2,同时ZnFe2Oy转变为ZnFe2O4。若2 mol ZnFe2Oy与足量NO2可生成0.5 mol N2,则y=_______________。
(1)①NaHCO3 ②2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
(2)B; Na2CO3·NaHCO3·2H2O, 112 (3)3
解析试题分析:(1)①化学反应的过程就是原子重新组合的过程。在这个过程中,元素的种类及原子个数不变。可得A化学式为:NaHCO3。该反应中H2O2只发生了如下过程:H2O2→ O2。H2O2失去电子,作还原剂,则还有氧化剂MnO4-,反应后该微粒转化为Mn2+.结合原子守恒和电子守恒。可得离子方程式是:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑。(2) ①Na2CO3与盐酸反应分步进行。首先发生:Na2CO3+HCl="NaCl+" NaHCO3.当Na2CO3完全转化为NaHCO3后,发生NaHCO3+HCl=NaCl+H2O+CO2↑。若固体只含有Na2CO3,则前后两步消耗的盐酸物质的量相等。由于某天然碱的化学式可表示为:aNa2CO3·bNaHCO3·2H2O,还含有NaHCO3,故放出气体消耗的盐酸要比前半部分多。故B曲线正确。n(Na2CO3)=" 1" mol/L×2. 5×10-3L=2. 5×10-3 mol.n(NaHCO3)总="1" mol/L×5×10-3L=5×10-3 mol。所以原固体产生的碳酸氢钠的物质的量为:n(NaHCO3)= 5×10-3 mol-2. 5×10-3 mol.= 2. 5×10-3 mol。n(Na2CO3):n(NaHCO3)=1:1.所以某天然碱的化学式可表示为: Na2CO3·NaHCO3·2H2O。②n(CO2)= n(Na2CO3)+n(NaHCO3)= 5×10-3 mol.V(CO2)= n(CO2)·Vm=5×10-3 mol×22.4mol/L×103ml/L="112ml." (3)根据质量守恒定律可得2Y+X="8" 讨论求解得:X=2,Y=3.物质化学式成立。
考点:考查质量守恒定律、氧化还原反应方程式的书写、碳酸钠与盐酸的分步反应等知识。


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案科目:高中化学 来源: 题型:填空题
二氧化氯(ClO2)是目前国际上公认的第四代高效、无毒的消毒剂,是一种黄绿色的气体,易溶于水。
Ⅰ.(1)ClO2可由KClO3在H2SO4存在的条件下与Na2SO3反应制得。则该反应的氧化产物与还原产物的物质的量之比是________。
Ⅱ.实验室也可用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2,其流程如下: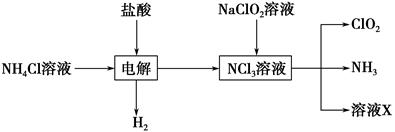
(2)写出电解时发生反应的化学方程式:________________________________。
(3)除去ClO2中的NH3可选用的试剂是________。(填序号)
| A.饱和食盐水 | B.碱石灰 |
| C.浓硫酸 | D.水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]·3H2O。42.2 g K4[Fe(CN)6]·3H2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如下图所示。
试回答下列问题:
(1)试确定150 ℃时固体物质的化学式_____________。
(2)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN)。据此判断,烹饪食品时应注意的问题为_____________________________________________________。
(3)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O=2H2SO4的转化。已知,含SO2的废气通入含Fe2+、Fe3+的溶液中时,其中一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,则另一个反应的离子方程式为__________________________。
(4)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36。室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为3时,通过计算说明Fe3+是否沉淀完全_____________。(提示:当某离子浓度小于10-5 mol·L-1时可以认为该离子沉淀完全)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有下列物质:① 氢氧化钠固体;② 铜丝;③ 氯化氢气体;④ 稀硫酸;⑤ 二氧化碳气体; ⑥氢氧化钾溶液;⑦ 碳酸钠粉末;⑧ 蔗糖晶体;⑨ 熔融氯化钠,请用序号填空:
(1)上述状态下可导电的是________;(2)属于电解质的是________;(3)属于非电解质的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
根据要求回答下列各题
(Ⅰ)现有 ①铝 ②NH3③氢氧化钠溶液 ④液态氯化氢 ⑤AgCl固体⑥冰醋酸 ⑦蔗糖,填空回答(填序号):
以上物质中(1)属于电解质的是 ;(2)属于非电解质的是 ;
(3)属于强电解质的是 ;(4)能导电的是 。
(Ⅱ)写出下列反应的化学方程式:
①有NaHCO3生成的化合反应
② 有MgCl2参加的分解反应
③ 有Fe2O3参加的置换反应
④ 有HNO3生成的复分解反应
(Ⅲ).同温同压条件下,同体积的CH4和SO2的质量之比是 ;同质量的CH4和SO2的体积之比是 ;若两者所含原子个数总数相等,则CH4和SO2的质量之比是 。
(Ⅳ)把铁片和石墨棒用下列a、b两种方式放在盛有稀硫酸钠溶液和酚酞试液混合溶液的玻璃器皿中,经过一段时间后,首先观察到溶液变红的区域是 (填序号)。
| A.Ⅰ和Ⅲ附近 | B.Ⅰ和Ⅳ附近 | C.Ⅱ和Ⅲ附近 | D.Ⅱ和Ⅳ附近 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
⑴按要求写出下列反应的离子方程式
①氢氧化铜溶于盐酸
②碳酸钠溶液中和足量的盐酸溶液混合
(2)现有以下物质:①NaCl晶体 ②液态HCl ③CaCO3固体 ④熔融KCl ⑤蔗糖⑥铜⑦CO2⑧H2SO4⑨KOH固体 ⑩水⑾盐酸⑿CH3COOH ⒀酒精(填序号)
①以上物质中能导电的是_________________________________。
②以上物质中属于电解质的是_____________________________。
③以上物质中属于非电解质的是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某种物质溶于水后得到的溶液中,含有Fe2+、Fe3+、SO42-、NH4+、Ba2+、CO32-离子中的某几种。
(1)甲同学欲探究溶液的组成,进行了如下实验:①取少量溶液于试管中,逐滴加入浓氢氧化钠溶液,发现开始生成白色沉淀,白色沉淀迅速变为灰绿色,最后变为红褐色,同时伴有刺激性气体放出;②另取少量溶液于试管中,加入足量盐酸酸化后再滴加氯化钡溶液,有白色沉淀生成。
该溶液中一定含有的离子是 ;
写出①中白色沉淀转化为红褐色沉淀的化学方程式 。
(2)乙同学进行如下实验:取少量溶液于试管中,滴加几滴硫氰酸钾溶液,无明显现象;再滴加H2O2,发现溶液变红色;继续滴加H2O2,红色逐渐褪去且有气泡产生。为弄清其中缘由,乙同学查阅资料知:
H2O2+SCN-→SO42-+CO2↑+N2↑+H2O+H+
①该反应中,被氧化的元素为 ,每生成lmol CO2转移的电子数为 NA;
②根据乙同学的实验现象,请判断还原性强弱为:Fe2+ SCN-(填<、=或>);
③根据资料,乙同学提出的猜想是:H2O2将SCN-氧化使红色逐渐褪去。请你设计一个实验,验证乙同学的猜想是否正确 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某透明澄清溶液可能含有Na+、Fe3+、Ba2+、CO32-、SO32-、SO42-、Cl-、I-等离子中的几种,为鉴别这些离子,分别取三份少量溶液,按照以下顺序进行三个实验:
实验①:加CCl4,再滴加少量氯水,振荡后,CCl4后层变为紫色;
实验②:加盐酸后,生成无色无味气体,该气体能使饱和石灰水溶液变浑浊;
实验③:加BaCl2溶液产生白色沉淀,过滤出沉淀,在沉淀中加入足量盐酸,沉淀不能完全溶解。
(1)分析上述3个实验,用离子符号写出每一个实验得出的结论,可不必完全填满。
实验①:含有 ;不含 ;
实验②:含有 ;不含 ;
实验③:含有 ;不含 ;
(2)通过上述实验,不能确定是否存在的离子是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有一固体混合物,可能由Na2CO3、Na2SO4、FeSO4、CaCl2、NaCl等混合而成,为检验它们,做了以下实验:
① 将固体混合物溶于水中,搅拌后得无色透明溶液;
② 往此溶液中滴加硝酸钡溶液,有白色沉淀产生;
③ 过滤,将沉淀物置于足量稀硝酸中,发现沉淀部分溶解。
根据上述实验事实,回答下列问题:
(1)原固体混合物中一定含有的物质是 ,一定不含有的物质是 ,(均填化学式)。对可能含有的物质,可采用向滤液中滴加 溶液的方法来检验。
(2)写出步骤③中的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com