
| 实验步骤 | 预期现象和结论 |
步骤1:取少量吸收液于试管中,滴加3moL?L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. | / |
| 步骤2: | |
| 步骤3: |
| 步骤2:在A试管中滴加紫色石蕊试液 | 若先变红后退色,证明有ClO-,否则无 |
| 步骤3:在B试管中滴加0.01mol?L-1KMnO4溶液 | 若紫红色退去,证明有SO32-,否则无 |


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
| A、按系统命名法:CH3CH2C(CH3)2CH(C2H5)CH3的正确名称是3,3,4-三甲基己烷 |
| B、所有的糖、油脂、蛋白质都能水解,但水解产物不同 |
C、1mol的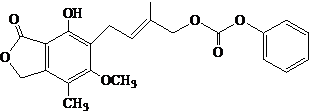 最多能与含5mol NaOH的水溶液完全反应 最多能与含5mol NaOH的水溶液完全反应 |
D、若完全燃烧,1mol雄酮( 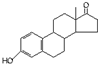 )比雌酮( )比雌酮(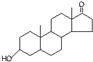 )多消耗3mol O2. )多消耗3mol O2. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NO是汽车尾气的有害成分之一 |
| B、NO是具有刺激性气味的红棕色气体 |
| C、NO极少量时在人体的血管系统内会促进血管扩张,防止血管栓塞 |
| D、NO能够与人体血红蛋白结合,吸入较多会造成人体缺氧中毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 【化学-选修3:物质结构与性质】
【化学-选修3:物质结构与性质】- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com