
| A. | KOH(aq) | B. | NaOH(aq) | C. | BaCl2(aq) | D. | Ba(OH)2(aq) |
科目:高中化学 来源: 题型:填空题
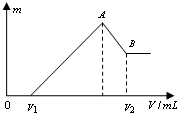 将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸式滴定管未用待测盐酸润洗 | |
| B. | 碱式滴定管未用标准碱液润洗 | |
| C. | 锥形瓶用蒸馏水洗净后未用待测液润洗 | |
| D. | 滴定前仰视读数,滴定后平视读数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=+725.8kJ•mol-1 | |
| B. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452kJ•mol-1 | |
| C. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.8kJ•mol-1 | |
| D. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=+1452kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,14g一氧化碳所占体积为11.2 L | |
| B. | 等物质的量的Na2O2和Na2O中所含阴阳离子总数相等 | |
| C. | NO的摩尔质量为30g | |
| D. | 常温常压下32g臭氧中含有的氧原子数目比标准状况下22.4L氧气中含有的氧原子数目少 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量 | 35±15mg/kg |
| 储藏方法 | 密封、避光、防潮 |
| 食用方法 | 烹饪时,待食品熟后加入碘盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,负极的电极反应式:Li-e-═Li+ | |
| B. | 充电时,Li0.85NiO2只发生氧化反应 | |
| C. | 该电池不能用水溶液作为电解质 | |
| D. | 放电过程中Li+向正极移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com