
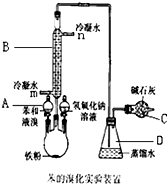
 实验室用图装置制取少量溴苯,试填写下列空白.
实验室用图装置制取少量溴苯,试填写下列空白. ;
;分析 (1)熟悉仪器的性质,说出其名称;
(2)液溴与苯在铁做催化剂条件下发生取代反应生成溴苯和溴化氢;
(3)溴化氢易溶于水,容易发生倒吸;
(4)溴与氢氧化钠反应生成溴化钠和次溴酸钠;
(5)根据冷凝效果判断水的流动方向,反应尾气中有挥发的溴和生成的溴化氢,能污染空气,所以要吸收尾气.
解答 解:(1)依据仪器形状可知:A为分液漏斗,B为冷凝管;
故答案为:分液漏斗;冷凝管;
(2)苯与液溴在Fe的催化作用下发生取代反应生成溴苯,其反应的化学方程式为: ;
;
故答案为: .
.
(3)溴化氢易溶于水,容易发生倒吸,长导管的下口不插入锥形瓶可以防止倒吸的发生;
故答案为:防止倒吸;
(4)反应后生成的溴苯中含有少量的溴,溴苯与氢氧化钠不反应,溴与氢氧化钠反应生成溴化钠和次溴酸钠,可用NaOH溶液洗涤除去溴苯中的溴;
故答案为:除去溴苯中的溴;
(5)冷凝水的流动方向应自下而上,这样的冷却效果好,确保充分冷却,反应尾气中有挥发的溴和生成的溴化氢,能污染空气,所以要用碱石灰吸收尾气,
故答案为:m;吸收多余HBr气体,防止空气污染.
点评 本题主要考查了苯的性质实验,掌握反应的原理、各物质的性质以及操作的方法是解题的关键,难度不大.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
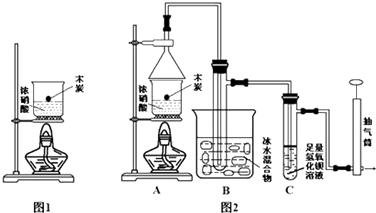
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
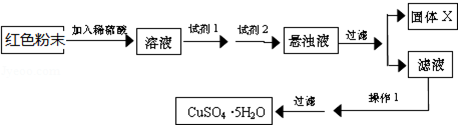
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铜丝插入浓硫酸加热,反应后把水加入反应器中,观察硫酸铜溶液的颜色 | |
| B. | 常温下将铜丝伸入盛满氯气的集气瓶中,观察CuCl2的生成 | |
| C. | 电解CuCl2溶液,若阳极生成11.2L的气体,反应中转移电子为1 mol | |
| D. | 将表面有铜绿的铜器放入盐酸中浸泡,除去铜绿 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
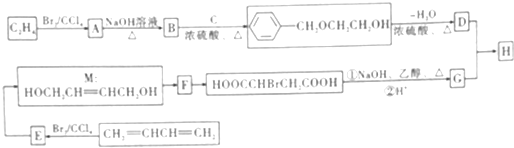
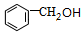 ,F中官能团的名称为羟基、溴原子
,F中官能团的名称为羟基、溴原子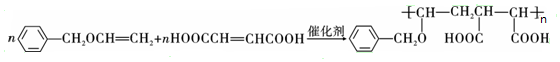
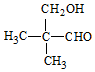 或
或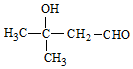 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com