

| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp | 2.2×10-20 | 8.0×10-16 | 4.0×10-38 |
| 4.0×10-38 |
| (10-10)3 |
| 17.22g |
| 143.5g/mol |
| 0.64g |
| 160g/mol |
| 0.008mol |
| 0.02L |
| 1 |
| 2 |
| 0.016mol |
| 0.02L |
| 0.032mol |
| 0.02L |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 一定温度压强下,用m g的CH4、CO2、O2、SO2四种气体分别吹出四个体积大小不同的气球,下列说法中正确的是( )
一定温度压强下,用m g的CH4、CO2、O2、SO2四种气体分别吹出四个体积大小不同的气球,下列说法中正确的是( )| A、气球B中装的是O2 |
| B、气球A和气球C中气体分子数相等 |
| C、气球A和气球D中气体物质的量之比为4:1 |
| D、气球C和气球D中气体密度之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
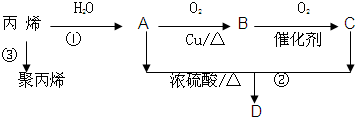
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Cu2+、Cl-、SO42- |
| B、Fe3+、K+、SO42-、NO3- |
| C、Zn2+、Mg2+、HSO3-、SO42- |
| D、Na+、Ca2+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com