
【题目】砷(As)及其化合物在生产、医疗、科技等方面有许多应用
(1)中国自古“信口雌黄”、“雄黄入药”之说。雄黄As2S3和雌黄As4S4都是自然界中常见的砷化物,早期都曾用作绘画颜料,因都有抗病毒疗效也用来入药。一定条件下,雌黄和雄黄的转化关系如图所示。

①砷元素有+2、+3+5等常见价态。,雌黄和雄黄中S元素的价态相同,其价态是______________。I中发生的离子方程式是______________________________。
②Ⅱ中,雄黄在空气中加热至300℃时会产生两种物质,若4.28g As4S4反应转移0.28mole-,则a为_______________(填化学式)砒霜(As2O3)可用双氧水将氧化成H3AsO4而除去,该反应的化学方程式为:____________________________________。
(2)AsH3是一种很强的还原剂,室温下, 0.4mol AsH3气体在空气中自燃,氧化产物为As2O3固体,放出b kJ 热量,AsH3自燃的热化学方程式是:____________________________________。
(3)将Na3AsO3(aq)+I2(aq)+H2O(l)![]() Na2HasO4(aq)+NaI (aq)设计成原电池如图所示,放电时电流强度(I)与时间关系如图所示.
Na2HasO4(aq)+NaI (aq)设计成原电池如图所示,放电时电流强度(I)与时间关系如图所示.
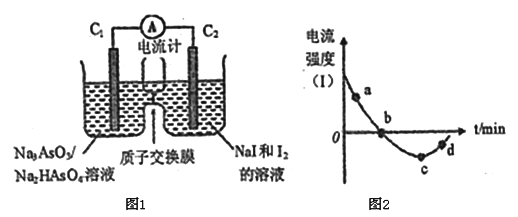
①如图中表示在该时刻上述可逆反应达到平衡状态的点是_________________(填字母)。
②已知:a点对应如图中电流由C1极经外电路流向C2极。则d点对应的负极的反应式为_____________。
③如图中,b→c改变条件可能是____________(填代号),c→d电流强度变化的原因是___________。
A.向左室中加入适量的浓Na3AsO3溶液 B.向左室中加入适量的烧碱溶液
C.向右室中加入适量的浓KI溶液 D. 向右室中加入适量的稀硫酸
【答案】 -2 4H++2Sn2++2As2S3=2H2S↑+2Sn4++As4S4 SO2 As2O3+2H2O2+H2O=2H3AsO4 2AsH3(g)+3O2(g)= As2O3(s)+3H2O(l)△H=-5bKJ/mol b AsO32--2e-+H2O=HasO42-+H+ AB 停止改变条件,随着正反应进行,反应浓度下降,反应速率下降,单位时间转移的电子(电量)减少
【解析】①雌黄和雄黄中S元素的价态相同,其价态是-2价。I中Sn2+被氧化,发生反应的离子方程式是4H++2Sn2++2As2S3=2H2S↑+2Sn4++As4S4。②若4.28g As4S4即0.01mol,反应转移0.28mole-,因此1mol雄黄失去28mol电子,其中As失去4mol电子,所以S失去6个电子,其化合价从-2价升高到+4价,则a为SO2;砒霜(As2O3)可用双氧水将氧化成H3AsO4而除去,该反应的化学方程式为As2O3+2H2O2+H2O=2H3AsO4。(2)AsH3是一种很强的还原剂,室温下,0.4mol AsH3气体在空气中自燃,氧化产物为As2O3固体,放出b kJ热量,所以AsH3自燃的热化学方程式是2AsH3(g)+3O2(g)= As2O3(s)+3H2O(l)△H=-5bkJ/mol。(3)①可逆反应达到平衡状态时电流为0,则平衡点是b。②已知:a点对应如图中电流由C1极经外电路流向C2极,则C1是正极,所以d点时C1是负极,对应的负极的反应式为AsO32--2e-+H2O=HAsO42-+H+。③如图中,b→c反应说明电池反应倒过来,改变条件可能是向左室中加入适量的浓Na3AsO3溶液或向左室中加入适量的烧碱溶液,向右室中加入适量的浓KI溶液或向右室中加入适量的稀硫酸不利于反应倒过来进行,答案选AB。c→d电流强度变化的原因是由于停止改变条件,随着正反应进行,反应浓度下降,反应速率下降,单位时间转移的电子(电量)减少。


科目:高中化学 来源: 题型:
【题目】下列根据实验操作和现象所得出的结论,错误的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 | 2min 后,试管里出现凝胶 | 酸性:盐酸>硅酸 |
B | 常温下,向浓硝酸中投入铁片 | 铁片不溶解 | 常温下,铁不与浓硝酸反应 |
C | 在酒精灯上加热铝箔 | 铝箔熔化但不滴落 | 熔点;氧化铝>铝 |
D | 向某溶液中先滴加KSCN溶液,再滴加少量氯水 | 先无明显现象,后溶液变成红色 | 溶液中含有Fe2+,没有Fe3+ |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是( )
A. 1 molCH3COOH与1mol CH3CH2OH在浓硫酸共热下生成的乙酸乙酯分子数为NA
B. 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA
C. 7.8g ![]() 中含有的碳碳双键数为0.3NA
中含有的碳碳双键数为0.3NA
D. 标准状况下,11.2L的戊烷所含的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知溶液中:还原性HSO3->I-,氧化性IO3-> I2> SO42-。在含3 molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,试回答下列问题:

(1)写出a点反应的离子方程式__________________________;反应中还原剂是________;被还原的元素是________。
(2)写出b点到c点反应的离子方程式__________________________________________。
(3)当溶液中的I-为0.4 mol时,加入的KIO3为____________mol。
(4)若往100 mL1mol/L的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰基丙烯酸酯在碱性条件下能快速聚合为 ,从而具有胶黏性。某种氰基丙烯酸酯(G)的合成路线如下:
,从而具有胶黏性。某种氰基丙烯酸酯(G)的合成路线如下:
![]()

已知:①A的相对分子质量为58,氧元素质量分数为0.276,核磁共振氢谱显示为单峰。

回答下列问题:
(1)由A生成B的反应类型________________
(2)C的结构简式为______,其核磁共振氢谱显示为_______组峰,C的二氯代物有______种。
(3)由D生成E的反应条件为_________________
(4)G的聚合物在酸性条件下水解的化学方程式 _________________________________
(5)D中的官能团有______、______、______(填官能团名称)
(6)G的同分异构体中,与G具有相同官能团且能发生银镜反应的共有___________种。(不含立体结构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取气体的装置如下图所示,根据所学知识,回答下列问题:

(1)图中标有①②的仪器名称:①_____________;②___________。
(2)写出一个用装置A制取氧气的化学方程式_______________________________。
(3)实验室用石灰石和稀盐酸反应制取二氧化碳时,应选用图中_________和______ 来组装一套实验装置,检验二氧化碳集满的方法_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下列两种方法制取氯气:①用含HCl146g的浓盐酸与足量的MnO2反应;②用87gMnO2与足量浓盐酸的反应,则所得Cl2
A. ①比②多 B. ②比①多 C. 一样多 D. 无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓差电池中的电动势是由于电池中存在浓度差而产生的。某浓差电池的原理如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能。下列有关该电池的说法错误的是

A. 电池工作时,Li+通过离子电子导体移向b区
B. 电流由X极通过外电路移向Y极
C. 正极发生的反应为:2H++2e-=H2↑
D. Y极每生成1 mol Cl2,a区得到2 mol LiCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com