
| A、NaHSO4溶液与Ba(OH)2溶液混合后溶液呈中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O | ||||
| B、将标准状况下112 mL氯气通入10 mL 1 mol?L-1的溴化亚铁溶液中:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2 | ||||
C、用惰性电极电解饱和MgCl2溶液:2Cl-+2H2O
| ||||
| D、向澄清石灰水中加入过量的碳酸氢钠溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O |
| 0.112L |
| 22.4L/mol |
| ||


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
A、用惰性电极电解饱和MgCl2溶液:2Cl-+2H2O
| ||||
| B、将标准状况下112 mL氯气通入10 mL 1 mol?L-1的溴化亚铁溶液中:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2 | ||||
| C、NaHSO4溶液与Ba(OH)2溶液混合后溶液呈中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O | ||||
| D、向澄清石灰水中加入过量的碳酸氢钠溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
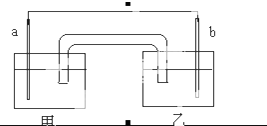 某化学兴趣小组设计如图原电池:其中a、b分别为Cu和Ag,甲和乙分别是氨水和硝酸银溶液,盐桥的琼脂中吸附有KCl溶液,反应一段时间后,下列说法正确的是( )
某化学兴趣小组设计如图原电池:其中a、b分别为Cu和Ag,甲和乙分别是氨水和硝酸银溶液,盐桥的琼脂中吸附有KCl溶液,反应一段时间后,下列说法正确的是( )| A、b为负极,电极方程式为:Ag++e-═Ag |
| B、甲中出现大量蓝色沉淀 |
| C、总反应为:Cu+2Ag+═Cu2++Ag |
| D、反应时,盐桥中的K+向乙方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
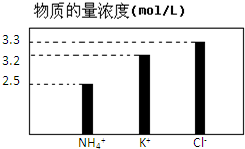 在无土栽培中,需配置20L含NH4Cl、KCl和K2CO3的营养液.营养液中部分离子的物质的量浓度如图所示.若用KCl、NH4Cl和(NH4)2CO3三种固体为原料来配制上述营养液,则需KCl、NH4Cl和(NH4)2CO3三种固体得物质的量依次为(单位为mol)( )
在无土栽培中,需配置20L含NH4Cl、KCl和K2CO3的营养液.营养液中部分离子的物质的量浓度如图所示.若用KCl、NH4Cl和(NH4)2CO3三种固体为原料来配制上述营养液,则需KCl、NH4Cl和(NH4)2CO3三种固体得物质的量依次为(单位为mol)( )| A、2、64、24 |
| B、16、50、24 |
| C、32、50、12 |
| D、64、2、24 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属铝和过量的氢氧化钠溶液反应:2OH-+Al═AlO2-+H2↑ |
| B、氯化铁溶液中加入铁粉:2Fe3++Fe═3Fe2+ |
| C、稀硫酸与氢氧化钡溶液反应:H++OH-═H2O |
| D、向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
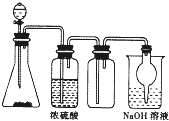 如图是一套实验室制取气体装置,用于发生、干燥、收集和吸收有毒气体,下列各实验能利用这套装置进行的是( )
如图是一套实验室制取气体装置,用于发生、干燥、收集和吸收有毒气体,下列各实验能利用这套装置进行的是( )| A、MnO2和浓盐酸制氯气 |
| B、锌粒和稀硫酸制氢气 |
| C、铜片和浓硝酸制二氧化氮 |
| D、浓氨水和生石灰制氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
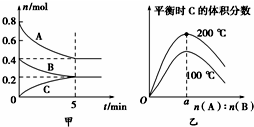 在2L的密闭容器中发生反应xA(g)+yB(g)?zC(g).图甲表示200℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是( )
在2L的密闭容器中发生反应xA(g)+yB(g)?zC(g).图甲表示200℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是( )| A、200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol?L-1?min-1 |
| B、200℃时,该反应的平衡常数为25 L2/mol2 |
| C、当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大 |
| D、由图乙可知,反应xA(g)+yB(g)?zC(g)的△H<0,且a=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 2013年9月,中国华北华中地区发生了严重的雾霆天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霆形成的原因.
2013年9月,中国华北华中地区发生了严重的雾霆天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霆形成的原因.| 催化剂 |
| 实验组 | 温度 ℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:
 分子中含氧官能团的名称是
分子中含氧官能团的名称是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com